فهرست عناوین
- مقدمه
- فرمول شیمیایی و ترکیب
- ساختار مولکولی و پیوندها
- خواص فیزیکی هیپوکلریت سدیم
- خواص شیمیایی و پایداری
- تولید و سنتز
- غلظت ها و گریدهای مختلف محلول هیپوکلریت سدیم
- عملکرد گندزدایی (خاصیت میکروب کشی)
- کاربردهای خانگی (سفیدکنندگی و پاک کنندگی)
- کاربرد در تصفیه آب و فاضلاب
- کاربردهای صنعتی هیپوکلریت سدیم
- مقایسه با سایر عوامل سفیدکننده
نوشته شده توسط شرکت صنایع ژاول ایران
منتشر شده توسط شرکت صنایع ژاول ایران
تاریخ انتشار مقاله : 30-05-1404
تاریخ بروزرسانی مقاله : 30-05-1404
تعداد کلمات : 2700
آدرس مقاله : لینک مقاله
ترکیب شیمیایی و فرمول آب ژاول

مقدمه
آب ژاول چیست ؟ تعریف و کاربردها ، بدین صورت است که یک ترکیب شیمیایی پرمصرف می باشد که به عنوان ماده مؤثره مایع سفید کننده خانگی شناخته می شود. این ماده به صورت محلولی زرد کم رنگ با بوی تند کلر ظاهر می شود و به خاطر خواص قوی سفید کنندگی و گندزدایی خود بسیار مشهور است. محلول هیپوکلریت سدیم با نام تجاری آب ژاول نیز شناخته می شود و در فارسی عامیانه گاهی به آن وایتکس می گویند. کاربردهای این ترکیب بسیار گسترده است ؛ از ضد عفونی کردن سطوح و لباس ها گرفته تا تصفیه آب آشامیدنی و حتی مصارف پزشکی و دندانپزشکی از هیپوکلریت سدیم بهره می گیرند. در ادامه ، جزئیات کامل تری درباره فرمول شیمیایی ، ترکیب ، ساختار ، خواص ، تولید و کاربردهای مختلف این ماده ارائه شده است.
فرمول شیمیایی و ترکیب
هیپوکلریت سدیم فرمول شیمیایی NaClO دارند که نشان میدهد از اتم های سدیم (Na)، کلر (Cl) و اکسیژن (O) به نسبت ۱:۱:۱ تشکیل شده است. این ترکیب در واقع نمک سدیم اسید هیپوکلروس (HClO) محسوب می شود ؛ یعنی متشکل از کاتیون های سدیم (Na+) و آنیون های هیپوکلریت (ClO-). جرم مولی هیپوکلریت سدیم حدود ۷۴.۴۴ گرم بر مول است. فرمول ساده آن شباهت اسمی به نمک طعام سدیم کلرید با فرمول NaCl دارد اما اضافه شدن یک اتم اکسیژن تفاوت شیمیایی بسیار زیادی ایجاد کرده است. در محلول آبی ، این ترکیب به یون های سازنده خود یعنی Na+ و ClO- تفکیک می شود که بیانگر ماهیت یونی آن است.
ساختار مولکولی و پیوندها
هرچند معمولاً درباره فرمول مولکولی هیپوکلریت سدیم صحبت می شود ، اما در واقع این ماده یک ترکیب یونی است. در ساختار آن ، یون های مثبت سدیم و یون های منفی هیپوکلریت در حالت جامد کنار هم قرار گرفته و تشکیل یک شبکه یونی می دهند. آنیون هیپوکلریت (ClO-) از یک اتم کلر است که به یک اتم اکسیژن با پیوند کووالانسی متصل شده و در مجموع یک بار منفی دارد. این آنیون دارای ساختار خمیده است (مشابه یون های مرتبط مانند کلریت و پرکلرات) زیرا اتم اکسیژن دارای جفت الکترون های ناپیوندی است که شکل مولکولی را تحت تأثیر قرار می دهند. در بلورهای هیپوکلریت سدیم (مثلاً در حالت پنتاهیدرات) ، هر کاتیون سدیم با آنیون های هیپوکلریت اطرافش به صورت الکترواستاتیکی برهمکنش دارد و شبکه منظمی ایجاد می کند. ماهیت یونی این ترکیب علت حلالیت بالای آن در آب و توانایی محلول هایش در هدایت الکتریسیته است.
خواص فیزیکی هیپوکلریت سدیم
هیپوکلریت سدیم خالص را می توان به شکل جامد نیز به دست آورد، اما به علت ناپایداری شدید ، معمولاً این ترکیب به صورت محلول آبی مورد استفاده قرار می گیرد. محلول های رایج آن (همان مایع سفید کننده) ظاهری زلال تا زرد کمرنگ دارند و بوی تند کلر از آن ها به مشام می رسد. شکل بدون آب (انیدروز) هیپوکلریت سدیم یک جامد سفیدرنگ است که فوق العاده ناپایدار بوده و حتی ممکن است در اثر گرما یا اصطکاک به صورت انفجاری تجزیه شود ، بنابراین در عمل با آن سروکار نداریم. این ماده را می توان به صورت بلورهای پایدار در حالت پنتاهیدرات (NaOCl·5H₂O) جدا کرد ؛ این بلورهای سبز مایل به زرد در دمای پایین پایدارند ولی در دمای اتاق به سرعت تجزیه می شوند (نقطه ذوب آن ها حدود ۱۸ درجه سلسیوس است). محلولهای هیپوکلریت سدیم خاصیت بازی (قلیایی) بالایی دارند ؛ به طوری که pH سفید کننده های تجاری معمولاً در محدوده ۱۱ تا ۱۳ است. برای حفظ پایداری محلول ، مقداری سدیم هیدروکسید به آن اضافه می شود تا محیط قلیایی بماند و از تجزیه سریع هیپوکلریت جلوگیری شود. چگالی محلول های سفید کننده از آب بیشتر است مثلاً محلول ۵٪ وزنی NaOCl چگالی تقریباً ۱.۱ گرم بر میلی لیتر دارد و به هر نسبتی با آب مخلوط می شود.
خواص شیمیایی و پایداری
از دیدگاه شیمیایی هیپوکلریت سدیم یک عامل اکسید کننده قوی است. این ترکیب نسبتاً ناپایدار بوده و به ویژه در غلظت های بالا یا دمای زیاد به راحتی تجزیه می شود. در آب ، یون هیپوکلریت (OCl-) با اسید هیپوکلروس (HOCl) در تعادل است و نسبت این دو به میزان زیادی وابسته به pH محلول می باشد. در pH بالا (حدود ۱۱ تا ۱۳ مانند محلول های سفید کننده) ، فرم OCl- غالب است که پایداری محلول را بیشتر می کند. با این وجود محلول هیپوکلریت سدیم به مرور زمان به تدریج تخریب می شو د، به خصوص اگر در معرض گرما ، نور خورشید ، یون های فلزی یا محیط اسیدی قرار گیرد. محصول تجزیه تدریجی آن معمولاً سدیم کلرید (نمک طعام) و سدیم کلرات (NaClO₃) است و ممکن است اکسیژن گاز آزاد شود. برای مثال در دمای بالا ۳ واحد NaOCl می تواند به ۲ واحد NaCl و ۱ واحد NaClO₃ تبدیل شود. همچنین یک مسیر تجزیه دیگر تولید گاز اکسیژن می کند 2NaOCl⟶2NaCl+O2↑ . به همین دلیل محلول های سفید کننده در صورت انبارداری طولانی (به ویژه در شرایط نامناسب) بخشی از قدرت گندزدایی خود را از دست می دهند. واکنش هیپوکلریت سدیم با اسیدها بسیار شدید است و باعث آزاد شدن گاز خطرناک کلر (Cl₂) می شود. واکنش آن با آمونیاک یا ترکیبات آمونیوم نیز گازهای سمی (کلرامینها) تولید می کند. خاصیت اکسید کنندگی قوی این ماده به این معنی است که با بسیاری از مواد آلی واکنش نشان داده و آن ها را اکسید یا تجزیه می کند (این نحوه عملکرد در از بین بردن لکه های آلی و میکروب ها نقش دارد). در مجموع هیپوکلریت سدیم علی رغم ناپایداری نسبی به دلیل واکنش پذیری بالای خود یک ماده مؤثر برای گندزدایی و اکسیداسیون به شمار می آید ، هرچند باید شرایط نگهداری و استفاده آن تحت کنترل باشد تا از تجزیه یا واکنش ناخواسته جلوگیری شود.
تولید و سنتز
هیپوکلریت سدیم از قرن هجدهم میلادی به صورت صنعتی تولید شده است. روش کلاسیک تهیه آن ، واکنش کلر با محلول سدیم هیدروکسید (قلیا) است. واکنش اصلی چنین است: Cl₂ + 2 NaOH → NaOCl + NaCl + H₂O . در این واکنش گاز کلر (Cl₂) همزمان کاهش یافته به Cl-) و اکسید شده (به ClO- و در نتیجه یک فرایند خوداکسایش-کاهش رخ می دهد. این فرایند نخستین بار در سال ۱۷۸۹ توسط شیمیدان فرانسوی کلود لوئی برتوله انجام شد ؛ او با عبور دادن گاز کلر از محلول پتاس (پتاسیم هیدروکسید) محلول هیپوکلریت پتاسیم را تهیه کرد که به او دو ژاول (آب ژاول اولیه) معروف شد. آنتوان لاواراک چند دهه بعد با جایگزین کردن سود سوزآور ارزان تر به جای پتاس ، هیپوکلریت سدیم را تولید کرد (محلول او به نام آب لاواراک شناخته می شد) و کاربرد آن به عنوان ضد عفونی کننده نیز مطرح گردید. امروزه دمیدن کلر در محلول سرد سدیم هیدروکسید همچنان روش اصلی تولید هیپوکلریت سدیم در مقیاس صنعتی است. برای بهینه سازی ، واکنش را در دمای زیر ۴۰ درجه سلسیوس نگه می دارند تا تشکیل سدیم کلرات ناخواسته به حداقل برسد. محلول به دست آمده شامل هیپوکلریت سدیم در آب به همراه محصول جانبی نمک (سدیم کلرید) است. در مقیاس صنعتی ، همواره مقداری سدیم هیدروکسید اضافی به محلول اضافه می شود تا محیط را قلیایی نگه دارد و از تجزیه سریع هیپوکلریت طی انبارداری جلوگیری شود. روش دیگری که در گذشته استفاده می شد ، واکنش کربنات سدیم (کربنات شستشو) با هیپوکلریت کلسیم (پودر کلر) بود که هیپوکلریت سدیم محلول تولید می کرد (همراه با رسوب کربنات کلسیم). هر چند امروزه این روش چندان متداول نیست.
غلظت ها و گریدهای مختلف محلول هیپوکلریت سدیم
خرید آب ژاول سمنان به شکل محلول با درصدهای غلظت گوناگون عرضه می شود که هر کدام کاربرد خاص خود را دارند. سفید کننده های خانگی معمولاً حدود ۳ تا ۸ درصد وزنی هیپوکلریت سدیم دارند برای مثال بسیاری از سفید کنندههای خانگی کلاسیک دارای حدود ۵٪ NaOCl هستند. محلول های قوی تر تجاری برای مصارف صنعتی یا ضدعفونی آب ، غلظتی در حدود ۱۰٪ تا ۱۵٪ دارند. به عنوان نمونه در تصفیه خانه های آب آشامیدنی اغلب از محلول ۱۲٪ هیپوکلریت برای کلرزنی آب استفاده می شود و در تصفیه فاضلاب معمولاً محلول های ۱۵٪ به کار می روند. محلول های با غلظت بالاتر ناپایدارتر هستند و هنگام نگهداری ممکن است سریع تر تجزیه شوند یا گاز کلر آزاد کنند ، بنابراین باید در ظروف مناسب و شرایط خنک و تاریک ذخیره شوند. برای کاربردهای خانگی ، محصولات سفید کننده با نام های تجاری گوناگون در بازار موجودند که عمدتاً ترکیب فعال یکسانی دارند. لازم به ذکر است که قدرت سفیدکنندگی محلول های هیپوکلریت در طول زمان کاهش می یابد ؛ به طوری که در طی مثلاً یک سال نگهداری ممکن است درصد قابل توجهی از ماده فعال خود را از دست بدهند. از این رو توصیه می شود مایع سفید کننده را در جای خنک و دور از نور خورشید نگهداری کرده و برای حداکثر اثربخشی ظرف چند ماه مصرف کنید.
عملکرد گندزدایی (خاصیت میکروب کشی)
یکی از مهم ترین نقش های هیپوکلریت سدیم گندزدایی گسترده آن است. هیپوکلریت سدیم دارای طیف اثر بسیار گسترده است که آنرا به یکی از قوی ترین گندزداهای موجود تبدیل می کند ؛ به طوری که تقریباً همه انواع میکروب ها (باکتری ها ، ویروس ها ، قارچ ها و هاگ ها) را از بین می برد. مکانیزم اثر آن اکسید کردن اجزای حیاتی سلول های میکروبی است. زمانی که هیپوکلریت سدیم در آب حل می شود ، اسید هیپوکلروس (HOCl) تشکیل می گردد به خصوص در محلول های رقیق تر یا در pHهای پایین تر که عامل ضدعفونی کننده اصلی به شمار می رود. HOCl می تواند به دیواره سلولی میکروب ها نفوذ کرده و ترکیبات درون سلول مانند پروتئین ها و DNA را اکسید و تخریب کند. نتیجه این است که طی زمان کوتاهی ، سلول های میکروبی نابود می شوند. محلول های هیپوکلریت بسته به کاربرد رقیق می شوند : به طور معمول برای ضدعفونی سطوح آلوده به خون و مایعات بدن از محلول نسبتاً قوی حدود ۰.۵٪ (۵۰۰۰ قسمت در میلیون کلر آزاد) استفاده می شو د؛ در حالی که برای ضدعفونی عمومی و دست ها ، محلول ضعیف تر ۰.۰۵٪ ۵۰۰ ppm به کار می رود. (اغلب این محلول های رقیق شده با ترکیب پودر هیپوکلریت کلسیم در آب تهیه می شوند). همچنین محلول داکین که یک ضدعفونی کننده زخم معروف است ، در واقع هیپوکلریت سدیم ۰.۵٪ به همراه مقدار کمی اسید بوریک یا بی کربنات سدیم (به عنوان بافر) می باشد که برای شستشوی زخم ها به کار می رود.
کاربردهای خانگی (سفیدکنندگی و پاک کنندگی)
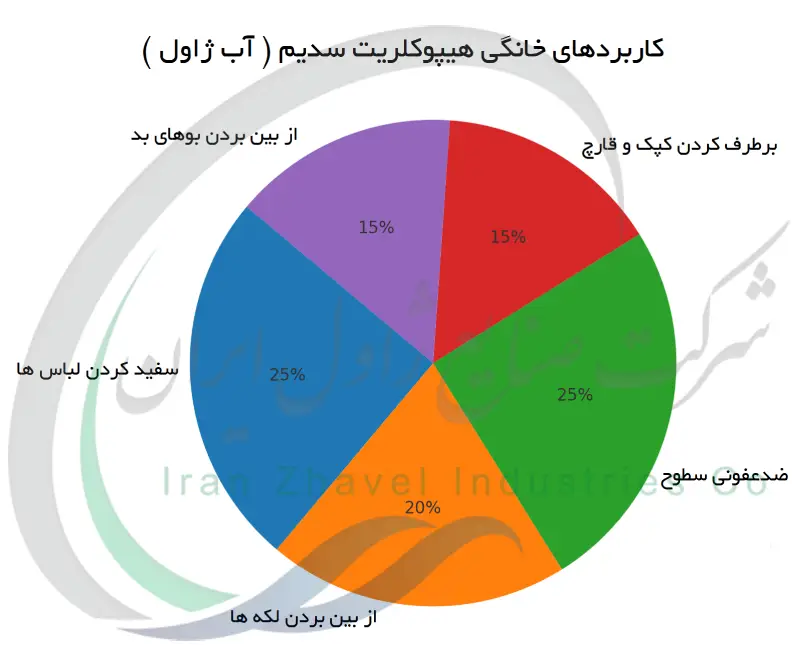
شهرت اصلی هیپوکلریت سدیم به عنوان وایتکس یا سفید کننده ، به توانایی آن در سفید کردن و تمیز کردن مربوط می شود. در خانه ها از محلولهای سفید کننده برای سفید کردن لباس های سفید و از بین بردن لکه های سخت استفاده می شود. این ماده از طریق اکسید کردن مولکول های رنگی (کروموفورها) در لکه ها عمل می کند و با شکستن ساختار شیمیایی آن ها باعث بی رنگ شدن و محو لکه هایی مانند قهوه ، چای ، شراب ، چمن و خون روی پارچه ها می شود. علاوه بر رخت شویی ، هیپوکلریت سدیم یک پاک کننده عمومی قدرتمند نیز هست. از آن برای تمیز و ضدعفونی کردن سطوح آشپزخانه و سرویس بهداشتی استفاده می کنند به عنوان مثال برای برطرف کردن کپک و قارچ از روی کاشی و سرامیک ، ضدعفونی سینک ها و کانترهای آشپزخانه و شستشوی وان و دستشویی. از بین بردن بوهای بد نیز جزو اثرات سودمند وایتکس است ، زیرا با اکسیداسیون ترکیبات آلی بدبو ، آن ها را بی بو و بی ضرر می کند. بسیاری از محصولات پاک کننده خانگی حاوی درصدی هیپوکلریت سدیم به عنوان ماده مؤثره هستند که برای همین خواص سفیدکنندگی ، بوزدایی و میکروب کشی افزوده می شوند. برخی شوینده های ویژه (مانند پاک کننده های کاسه توالت) با هیپوکلریت سدیم غلیظ تولید می شوند تا به سطوح عمودی چسبیده و اثر طولانی تری داشته باشند.
کاربرد در تصفیه آب و فاضلاب
هیپوکلریت سدیم نقش کلیدی در تصفیه آب و بهداشت عمومی ایفا می کند. این ماده به طور گسترده برای کلرزنی آب آشامیدنی و ضدعفونی فاضلاب و پساب ها استفاده می شود. در تصفیه خانه های آب شهری اغلب به جای استفاده مستقیم از گاز کلر خطرناک ، از محلول هیپوکلریت سدیم برای ضدعفونی آب بهره می گیرند. این محلول با رهاسازی کلر فعال به صورت HOCl در آب ، باکتری ها ، ویروس ها و سایر پاتوژن های موجود در آب را از بین می برد و آب را برای شرب ایمن می کند. کنترل دقیق دوز تزریقی ضروری است تا غلظت کلر باقی مانده در آب لوله کشی در حد مطلوب نگه داشته شود. در تصفیه فاضلاب پس از انجام مراحل دیگر تصفیه ، افزودن هیپوکلریت سدیم (اغلب با غلظت ~۱۵٪) به پساب خروجی ، میکروب های باقیمانده را نابود می کند تا تخلیه آن به محیط زیست ایمن تر باشد. در استخرهای شنا و آب گرم نیز هیپوکلریت سدیم به عنوان منبع تأمین کلر استفاده می شود. وایتکس مخصوص استخر (مایع کلر) معمولاً محلول غلیظ ۱۰–۱۲٪ است که به آب استخر اضافه شده و سطح کلر آزاد را در حد مطلوب نگه می دارد تا جلبک ها و میکروب ها رشد نکنند. البته هیپوکلریت سدیم مانند سایر روش های کلرزنی می تواند با مواد آلی آب واکنش داده و محصولات جانبی ایجاد کند (مثل تری هالومتان ها) ، از این رو در سیستم های بزرگ ، میزان و نحوه کلرزنی به دقت کنترل می شود و گاه از ترکیبات جایگزین مانند کلرامین ها برای ماندگاری بیشتر کلر در شبکه استفاده می شود.
کاربردهای صنعتی هیپوکلریت سدیم
در صنعت از هیپوکلریت سدیم در فرآیندهای مختلفی که نیازمند یک عامل اکسید کننده یا سفید کننده قوی هستند استفاده می شود. یکی از کاربردهای مهم آن سفید کردن خمیر کاغذ و منسوجات بوده است. در گذشته هیپوکلریت سدیم از نخستین سفیدکننده های شیمیایی برای سفید کردن چوب پالپ (در کاغذسازی) و پارچه های پنبه ای بود. این ماده با اکسید کردن ترکیبات رنگی در الیاف ، آن ها را سفید می کند. هرچند به دلیل ایجاد برخی مواد جانبی مضر (ترکیبات آلی کلردار) ، در صنعت کاغذ ، هیپوکلریت تا حد زیادی با مواد جایگزین مانند دی اکسید کلر در فرآیندهای ECF جایگزین شده است. با این حال هنوز هم در برخی مراحل خاص یا در مقیاس های کوچک تر از هیپوکلریت استفاده می شود. در صنعت نساجی نیز برای سفید کردن الیاف پنبه یا آماده سازی پارچه خام کاربرد داشته است. یکی دیگر از کاربردهای صنعتی هیپوکلریت سدیم به عنوان عامل اکسید کننده در فرآیندهای شیمیایی است. به عنوان مثال می توان از آن برای اکسید کردن ترکیبات آلی خاص استفاده کرد (مثلاً تبدیل برخی الکل ها به کتون یا آلدهید) زیرا یک اکسید کننده ارزان و در دسترس است. در سیستم های آبی صنعتی مانند برج های خنک کننده ، افزودن هیپوکلریت سدیم به آب به عنوان زیست کش مانع رشد جلبک ها و باکتری ها می شود و از تشکیل لجن زیستی جلوگیری می کند. در کارخانه های آبکاری و معادن که سیانید استفاده می شود ، هیپوکلریت سدیم برای خنثی سازی فاضلاب های حاوی سیانید کاربرد دارد ؛ این ماده یون سمی سیانید را اکسید کرده و به سیانات تبدیل می کند که کم خطرتر است. در صنایع غذایی نیز محلول های رقیق هیپوکلریت برای ضدعفونی سطوح تجهیزات و محیط استفاده می شود چون پس از شستشو اثری از خود باقی نمی گذارد جز کمی نمک.
مقایسه با سایر عوامل سفیدکننده
هیپوکلریت سدیم تنها ماده سفیدکننده و گندزدا نیست و در کنار آن ترکیبات دیگری مانند هیپوکلریت کلسیم ، گاز کلر ، کلرامین ها و حتی پراکسید هیدروژن نیز برای اهداف مشابه به کار می روند. بررسی مقایسه ای این مواد بر اساس فرمول شیمیایی ، حالت فیزیکی ، غلظت متداول و کاربردهای اصلی به ما کمک می کند تا مزایا و محدودیت های هرکدام را بهتر درک کرده و در شرایط مختلف بهترین گزینه را انتخاب کنیم.
| عامل سفیدکننده/گندزدا | فرمول شیمیایی | حالت فیزیکی | غلظت یا قدرت معمول | کاربردهای رایج |
|---|---|---|---|---|
| هیپوکلریت سدیم (مایع سفیدکننده) | NaOCl | مایع (محلول آبی) | سفیدکننده خانگی ~۵–۸٪ NaOCl؛ صنعتی تا ~۱۵٪ | سفید کردن لباسها، گندزدایی سطوح، کلرزنی آب آشامیدنی و استخرها |
| هیپوکلریت کلسیم (پودر کلر) | Ca(OCl)₂ | جامد (پودر/گرانول) | حدود ۶۵–۷۰٪ کلر فعال وزنی | کلرزن استخر، ماده گندزدا در تصفیه آب، سفیدکننده در صنایع نساجی/کاغذ |
| گاز کلر | Cl₂ | گاز (مایع فشرده در سیلندر) | ۱۰۰٪ کلر عنصری (دوز مصرفی چند mg/L در آب) | ضدعفونی مقیاس بزرگ آب شهری، تولید صنعتی سفیدکننده (تهیه NaOCl) |
| کلرامین (مونوکلرامین) | NH₂Cl | محلول در آب (تشکیل در محل) | مصرف ~۱–۵ mg/L در آب | ضدعفونی ثانویه آب آشامیدنی (ماندگاری بیشتر کلر در شبکه توزیع) |
| دی اکسید کلر | ClO₂ | گاز (تولید در محل به صورت محلول) | مصرف در آب در حد چند mg/L (باید تازه تولید شود) | ضدعفونی آب آشامیدنی (جایگزین کلر برای کاهش محصولات فرعی)، سفیدکننده خمیر کاغذ |
| اسید تری کلروایزوسیانوریک | C₃N₃O₃Cl₃ | جامد (قرص یا پودر) | ~۹۰٪ کلر قابلدسترس وزنی | کلرزنی تدریجی استخرها (قرص آهستهحل)، شوک کلر در استخرها، ضدعفونی آب در برجهای خنککننده |
| آب اکسیژنه (هیدروژن پراکسید) | H₂O₂ | مایع (محلول آبی) | خانگی ~۳٪؛ صنعتی ~۳۰٪ | سفیدکننده بدون کلر (برای پارچههای رنگی)، ضدعفونی زخمها و سطوح، سفیدکننده خمیر کاغذ همراه با کاتالیستها |





آشنایی با فرمول مولکولی و ساختار هیپوکلریت سدیم و بررسی کاربردهای آن
بررسی روند تولید آزمایشگاهی آب ژاول ، کاربردها و اهمیت آن
شناخت محلول هیپوکلریت سدیم و بررسی PH محلول آب ژاول و تاثیر آن بر خواص ماده
بررسی درصد وزنی/حجمی هیپوکلریت سدیم در آب ژاول های تجاری و پایداری و عمر مفید محلول های سفید کننده