فهرست عناوین
نوشته شده توسط شرکت صنایع ژاول ایران
منتشر شده توسط شرکت صنایع ژاول ایران
تاریخ انتشار مقاله : 04-06-1404
تاریخ بروزرسانی مقاله : 04-06-1404
تعداد کلمات : 2600
آدرس مقاله : لینک مقاله
فرمول مولکولی و ساختار هیپوکلریت سدیم

مقدمه
سدیم هیپوکلریت دارای فرمول مولکولی NaClO هستند و از یک اتم سدیم (Na)، یک اتم کلر (Cl) و یک اتم اکسیژن (O) تشکیل شده است. این ترکیب معدنی به عنوان سفید کننده مایع نیز شناخته می شود (با نام های آب ژاول یا وایتکس در بازار) و به خاطر توانایی بالای آن در ضدعفونی و رنگ بری به طور گسترده مورد استفاده قرار می گیرد. سدیم هیپوکلریت معمولاً به صورت محلول رقیق زرد مایل به سبز کم رنگ دیده می شود که بویی تند شبیه کلر دارد. سدیم هیپوکلریت نمک سدیم هیپوکلروس اسید است ؛ یعنی از کاتیون سدیم (Na+) و آنیون هیپوکلریت (ClO−) تشکیل شده.
فرمول و هویت شیمیایی هیپوکلریت سدیم
سدیم هیپوکلریت یک ترکیب معدنی است که فرمول شیمیایی آن NaClO یا به صورت NaOCl نیز نوشته می شود می باشد. این فرمول نشان می دهد که این ماده از یک اتم سدیم ، یک اتم کلر و یک اتم اکسیژن تشکیل شده است. جرم مولی هیپوکلریت سدیم حدود 74.44 گرم بر مول بوده و به عنوان نمک سدیم هیپوکلروس اسید طبقه بندی می شود. به عبارتی دیگر این ترکیب یک نمک غیرآلی است که از کاتیون سدیم و آنیون هیپوکلریت تشکیل شده است. هیپوکلریت سدیم خالص (فاقد آب) بسیار ناپایدار است، اما معمولاً به شکل محلول پایدار در آب وجود دارد که همان سفید کننده خانگی است. این محلول ظاهری مایع با رنگ زرد کم رنگ یا مایل به سبز دارد و بوی تند کلر مانندی متصاعد می کند. واژه هیپوکلریت در نام آن بیانگر حضور یون ClO− می باشد و آن را از ترکیبات دیگر کلر مانند سدیم کلرید نمک خوراکی با فرمول NaCl یا سدیم کلرات (NaClO3) متمایز می کند.
ساختار مولکولی و پیوندها در هیپوکلریت سدیم
در ترکیب سدیم هیپوکلریت نوع پیوندها و ساختار آن نشان دهنده ماهیت یونی این ماده است و نه یک مولکول مجزا. یون هیپوکلریت شامل یک اتم کلر و یک اتم اکسیژن می باشند که با پیوند کووالانسی به هم متصل شده اند و یک بار منفی اضافه بر روی این مجموعه وجود دارد (ClO−) . به عبارت دیگر کلر در این یون دارای عدد اکسایش +1 و اکسیژن دارای −2 است. کاتیون سدیم (Na+) در ساختار هیپوکلریت سدیم پیوند کووالانسی با یون OCl− ندارد ، بلکه صرفاً از طریق جاذبه الکترواستاتیکی در کنار آن قرار می گیرد. در حالت جامد مثلاً بلور پنج آبه ی NaOCl·5H2O ، این یون ها در یک شبکه منظم بلوری آرایش می یابند و مولکول های آب نیز میان لایه های کاتیون ها و آنیون ها جای می گیرند. در واقع چیزی به نام مولکول NaClO به صورت مستقل وجود ندارد ؛ زمانی که هیپوکلریت سدیم در آب حل می شود به طور کامل به یون های جداگانه Na+ و OCl− تفکیک می شود. پیوند بین اتم های اکسیژن و کلر در داخل آنیون هیپوکلریت نسبتاً قوی است ، اما این یون همچنان بسیار واکنش پذیر باقی می ماند ، به ویژه به خاطر بار منفی اکسیژن و وضعیت غیرمعمول کلر در عدد اکسایش +1. بنابراین ساختار هیپوکلریت سدیم را بهتر است به شکل یک ترکیب یونی متشکل از شبکه ای از یون های سدیم و هیپوکلریت توصیف کنیم تا یک مولکول منفرد.
خواص فیزیکی سدیم هیپوکلریت
سدیم هیپوکلریت در رایج ترین شکل خود به صورت محلول مایع شفاف با رنگ سبز مایل به زرد کمرنگ دیده می شود که بوی تند و مشخص کلر مانندی از آن به مشام می رسد. شکل جامد این ترکیب را می توان به صورت بلورهای پنج آبه (NaOCl·5H2O) به دست آورد که رنگشان زرد مایل به سبز روشن است. این بلورها فقط در دمای پایین پایدار هستند و حدود دمای اتاق آب شده و محلول ایجاد می کنند. هیپوکلریت سدیم بدون آب (خالص) یک جامد بلوری سفید رنگ است اما فوق العاده ناپایدار بوده و در اثر حرارت یا اصطکاک به سرعت تجزیه انفجاری می شود ؛ به همین دلیل عملاً به شکل خالص جداسازی یا نگهداری نمی گردد. محلول های هیپوکلریت سدیم چگالی اندکی بیشتر از آب دارند (مثلاً چگالی سفیدکننده های خانگی حدود 1.1 گرم بر میلی لیتر است) و شدیداً قلیایی هستند ، معمولاً با pH حدود 11 تا 13. این ترکیب در آب به شدت محلول است و محلول های غلیظی را تشکیل می دهد ، هرچند این محلول ها در طول زمان به تدریج (به ویژه تحت گرما یا نور) تجزیه می شوند. به طور کلی از نظر فیزیکی ، سدیم هیپوکلریت عمدتاً به شکل محلول آبی مورد استفاده قرار می گیرد ، چرا که شکل جامد آن به دلیل مشکلات پایداری عملاً کاربردی نیست.
رفتار شیمیایی و پایداری
از دیدگاه شیمیایی سدیم هیپوکلریت یک اکسید کننده قوی است ؛ به این معنا که به سرعت با بسیاری از مواد واکنش داده و آنها را اکسید می کند (با گرفتن الکترون از آنها). این ترکیب در محلول آبی و شرایط قلیایی و خنک تا حدی پایدار است ، اما حتی در انبارش نیز به مرور زمان تجزیه می شود. هنگامی که هیپوکلریت سدیم تجزیه می شود ، معمولاً سدیم کلرید (نمک طعام) و سدیم کلرات (NaClO3) تولید می کند و در برخی شرایط اکسیژن گاز آزاد می شود. دمای بالا ، نور خورشید پرتو UV و حضور ناخالصی هایی مانند یون های فلزات سنگین می تواند سرعت تجزیه آن را افزایش دهد. پایداری محلول سفیدکننده با نگه داشتن pH در سطح بالا عموماً با افزودن کمی سدیم هیدروکسید اضافی در مایع سفیدکننده تجاری برای نگهداشت pH ~12 به طور چشمگیری بیشتر می شود. اگر به محلول هیپوکلریت سدیم اسید اضافه شود ، واکنش سریعی رخ می دهد و گاز کلر (Cl2) آزاد می گردد؛ زیرا یون هیپوکلریت به هیپوکلروس اسید تبدیل شده و سپس در شرایط اسیدی به کلر تغییر می یابد. به همین ترتیب سدیم هیپوکلریت را هرگز نباید با آمونیاک یا ترکیبات آمونیوم مخلوط کرد چون واکنش آنها تولید بخارات سمی کلرامین می کند. عنصر کلر در یون هیپوکلریت دارای حالت اکسایش +1 است که میل دارد یا کاهش یابد و به کلرید (Cl−) تبدیل شود یا اکسایش یافته و به حالت های بالاتر برود ؛ به همین خاطر این ترکیب مستعد واکنش خود به خودی نامتناسب (disproportionation) است. در مجموع سدیم هیپوکلریت با اینکه ماده ای ناپایدار و بسیار واکنش پذیر است ، اما همین ویژگی اش عامل اثربخشی آن به عنوان ضدعفونی کننده و سفیدکننده قوی محسوب می شود.
تولید و سنتز هیپوکلریت سدیم
معمول ترین روش برای تولید هیپوکلریت سدیم ، واکنش دادن گاز کلر با محلول رقیق سدیم هیدروکسید است. این واکنش در اواخر قرن هجدهم کشف شد و هنوز پایه تولید صنعتی سفیدکننده را تشکیل می دهد. معادله واکنش کلی به صورت زیر است: Cl2 + 2 NaOH → NaCl + NaOCl + H2O . در عمل گاز کلر و سود سوزآور در شرایط کنترل شده دمای پایین حدود 20°C و غلظتی که از گرمای بیش از حد جلوگیری شودواکنش داده می شوند تا محلولی حاوی سدیم هیپوکلریت و سدیم کلرید (به عنوان محصول جانبی) حاصل گردد. این فرایند نیازمند خنک سازی است زیرا اگر دما بیش از حد بالا برود ، هیپوکلریت بیشتر واکنش داده و سدیم کلرات تولید می کند که بازده محصول موردنظر را کاهش می دهد. امروزه در مقیاس بزرگ از روشی موسوم به فرایند هوکر استفاده می شود که عملاً همان الکترولیز آب نمک (محلول سدیم کلرید) و ترکیب فوری کلر و سدیم هیدروکسید حاصله است. برخی از تأسیسات تولید هیپوکلریت سدیم را در محل با برقکافت مستقیم آب نمک تهیه می کنند که حاصل آن محلول سفیدکننده با غلظت پایین است. در هر صورت محصول نهایی معمولاً به صورت جامد خالص جدا نمی شود بلکه به شکل محلول آبی معمولاً حدود 12–15٪ NaOCl برای عرضه صنعتی یا ~5٪ برای سفیدکننده خانگی توزیع می گردد.
پیشینه تاریخی و کشف
قدرت سفیدکنندگی و ضدعفونی کنندگی محلول های هیپوکلریت در اواخر قرن هجدهم کشف شد. در سال 1789 شیمیدان فرانسوی کلود لوئی برتوله با عبور دادن گاز کلر از میان محلول پتاس (پتاسیم هیدروکسید) محلول هیپوکلریت پتاسیم را تولید کرد که به نام آب ژاول شهرت یافت. این نخستین سفیدکننده مبتنی بر کلر بود و نقطه ی آغاز روند تولید آزمایشگاهی آب ژاول محسوب می شود. چند دهه بعد حدود سال 1820 شیمیدان فرانسوی دیگری به نام آنتوان لا باراک دریافت که با جایگزین کردن پتاس با سدیم هیدروکسید ارزان تر می توان هیپوکلریت سدیم تهیه کرد ؛ محلولی که به عنوان محلول لا باراک معروف شد. این محلول های حاوی کلر به سرعت به دلیل توانایی شان در گندزدایی و از بین بردن بو شهرت یافتند (محلول لا باراک به طور قابل ملاحظه ای برای ضدعفونی بیمارستان ها و مبارزه با شیوع وبا در قرن نوزدهم به کار رفت). اصطلاح سفیدکننده به تدریج مترادف با همین محلول ها شد زیرا به طور گسترده برای سفید کردن لباس ها و ضدعفونی استفاده شدند. تا اواخر قرن نوزدهم روش های تولید صنعتی بهبود یافتند ؛ به عنوان مثال یک فرآیند الکتروشیمیایی برای تولید هیپوکلریت سدیم از آب نمک توسعه یافت. در اوایل قرن بیستم محصولات سفیدکننده خانگی به بازار عرضه شدند (برند آمریکایی کلراکس که در سال 1913 معرفی شد ، نمونه شناخته شده ای است). از آن زمان تاکنون هیپوکلریت سدیم به عنوان ماده ای اساسی در زمینه پاکیزگی و بهداشت باقی مانده است و تولید و مصرف آن در طول دو قرن گذشته به طور پیوسته افزایش یافته است.
اشکال مختلف هیپوکلریت سدیم و ویژگی های آنها
سدیم هیپوکلریت به صورت های گوناگونی وجود دارد که هر کدام خواص و کاربردهای متمایزی دارند. شکل واقعاً بدون آب این ترکیب NaClO خالص جامدی سفیدرنگ و بسیار ناپایدار است که اغلب به صورت انفجاری تجزیه می شود و بنابراین در عمل مورد استفاده قرار نمی گیرد. اما هیپوکلریت سدیم را می توان به شکل بلور پایدار پنج آبه (NaClO·5H2O) نیز تهیه کرد که جامدی زرد-سبز کم رنگ بوده و در دمای پایین پایدار است (این بلورها باید در یخچال نگهداری شوند و در نزدیکی دمای اتاق مایع می شوند). رایج ترین شکل این ماده محلول آبی آن در غلظت های مختلف است. سفیدکننده خانگی معمولاً محلول ~3–8٪ هیپوکلریت سدیم در آب است (اغلب در حدود 5٪) مایعی شفاف با رنگ زرد کمرنگ و بوی شدید که طی زمان به تدریج قدرت خود را از دست می دهد (به ویژه اگر در محیط گرم یا در معرض نور نگهداری شود). محلول های سفیدکننده صنعتی و مخصوص استخر غلیظ ترند معمولاً 10–15٪ NaOCl و باید در دمای کمتر از حدود 40°C نگهداری شوند تا از تجزیه سریع آنها جلوگیری شود. به همین دلیل بسیاری از صنایع برای تأمین نیاز خود اقدام به خرید آب ژاول کلران سمنان بشکه 220 لیتری می کنند تا علاوه بر برخورداری از کیفیت پایدار، سهولت در ذخیره سازی و استفاده در مقیاس بزرگ را نیز داشته باشند. در سوی دیگر طیف محلول های بسیار رقیق برای مثال 0.5٪ یا حتی تا 0.05٪ NaOCl برای اهداف ضدعفونی خاص به کار می روند : محلول داکین (~0.5٪ ، غالباً با بافر بوراته) به عنوان یک محلول ضد عفونی کننده برای شستشوی زخم ها استفاده می شود و محلول فوق العاده رقیق ~0.05٪ نیز می تواند برای ضدعفونی دست ها یا گندزدایی سطوح در محیط های بهداشتی به کار رود. جدول زیر اطلاعات کلیدی درباره این اشکال مختلف هیپوکلریت سدیم را خلاصه می کند:
| شکل/نوع | فرمول یا ترکیب | حالت و ظاهر فیزیکی | پایداری | موارد کاربرد / توضیحات |
|---|---|---|---|---|
| هیپوکلریت سدیم بدون آب | NaClO (فاقد آب) | جامد بلوری سفید | بسیار ناپایدار؛ در اثر حرارت یا ضربه شدیداً تجزیه انفجاری میشود | به دلیل ناپایداری خطرناک عملاً به شکل خالص استفاده نمیشود |
| هیپوکلریت سدیم پنج آبه | NaClO·5H2O | بلورهای جامد زرد مایل به سبز کم رنگ | در دمای پایین پایدار؛ در ~25°C ذوب شده و با گرم شدن تجزیه میشود | گاه برای مصارف آزمایشگاهی تهیه میشود؛ در دمای سرد پایدارتر از شکل بدون آب است |
| محلول سفیدکننده خانگی | ~5% وزنی NaOCl در آب | مایع شفاف زرد کمرنگ | در جای خنک و تاریک نسبتاً پایدار؛ طی چند ماه قدرت آن کاهش مییابد | سفیدکننده و ضدعفونی کننده متداول برای مصارف خانگی (لباس، سطوح) |
| محلول هیپوکلریت سدیم صنعتی (~12%) | ~12% وزنی NaOCl در آب | مایع شفاف زرد-سبز کمرنگ | در غلظت بالا ناپایدارتر؛ نیاز به نگهداری خنک (<40°C) دارد | استفاده در گندزدایی آب آشامیدنی، استخرها، ضدعفونی فاضلاب و مصارف صنعتی |
| محلول داکین (ضدعفونی زخم) | ~0.5% NaOCl + بافر | محلول شفاف (رقیق) | با وجود بافر نسبتاً پایدار؛ بهتر است تازه مصرف شود | محلول شستشوی زخم و ضدعفونی در پزشکی (معرفی در جنگ جهانی اول) |
| محلول شستشوی ریشه دندان | 1–5% NaOCl در آب | محلول شفاف | باید بلافاصله پس از تهیه مصرف شود؛ غلظت با گذشت زمان افت میکند | مورد استفاده در دندانپزشکی برای پاکسازی و ضدعفونی مجرای ریشه دندان |
| محلول ضد عفونی کننده بسیار رقیق | ~0.05% NaOCl در آب | محلول شفاف شبیه آب | باید سریعاً مصرف شود؛ بوی کلر بسیار کم؛ در صورت آلودگی سریع اثرش را از دست میدهد | برای ضدعفونی دستها (در شرایط اضطراری) یا گندزدایی آب آشامیدنی (نیازمند مقدار کم و زمان تماس کوتاه) |
کاربردهای صنعتی و تجاری
در صنعت هیپوکلریت سدیم به دلیل خواص اکسید کننده و ضدعفونی کننده قوی خود کاربردهای فراوانی دارد. در تصفیه خانه های آب و تأسیسات فاضلاب ، محلول های غلیظ NaOCl (حدود 10–15٪) به آب افزوده می شوند تا باکتری ها و ویروس های بیماری زا را از بین ببرند ؛ این شامل گندزدایی آب آشامیدنی ، فاضلاب تصفیه شده و آب استخرها می شود. در برج های خنک کننده نیروگاهی و سیستم های آب در کارخانجات کاغذسازی ، از هیپوکلریت سدیم به عنوان بایوساید برای مهار تشکیل خزه ، جلبک و باکتری استفاده می شود. در صنایع نساجی و کاغذسازی ، محلول های آب ژاول در گذشته برای سفید کردن پارچه ها و خمیر چوب استفاده می شدند ، هرچند امروزه برای کاهش تولید محصولات جانبی کلردار از سفیدکننده های جایگزین بهره می گیرند. صنعت غذا و نوشیدنی از هیپوکلریت سدیم برای ضدعفونی تجهیزات فرآوری و سطوح (مثلاً ضدعفونی کردن مخازن و خطوط تولید) استفاده می کند ، به شرط اینکه پس از آن اجازه دهند محلول باقی مانده به خوبی تخلیه یا شسته شود. در صنایع شیمیایی NaOCl به عنوان عامل اکسنده در برخی واکنش ها به کار گرفته می شود : این ماده می تواند ترکیبات آلی را اکسید کند (برای مثال اکسایش الکل ها به اسیدهای کربوکسیلیک یا تجزیه مواد رنگی در جریان پساب). کاربرد قابل توجه دیگر آن خنثی سازی پسماندهای صنعتی حاوی سیانید است ؛ هیپوکلریت سدیم سیانید سمی (CN−) را به سیانات کم خطرتر (OCN−) اکسید می کند. به شکل مشابه برای بی اثرسازی عوامل اعصاب در جنگ افزارهای شیمیایی از طریق اکسیداسیون ترکیبات سمی به مواد بی خطر نیز به کار رفته است. در مجموع در صنایع مختلف از پالایش نفت گرفته تا کشاورزی هیپوکلریت سدیم به عنوان ماده ای ارزان و موثر برای فرایندهای اکسیداسیون ، سفیدسازی و ضدعفونی ارزشمند است.
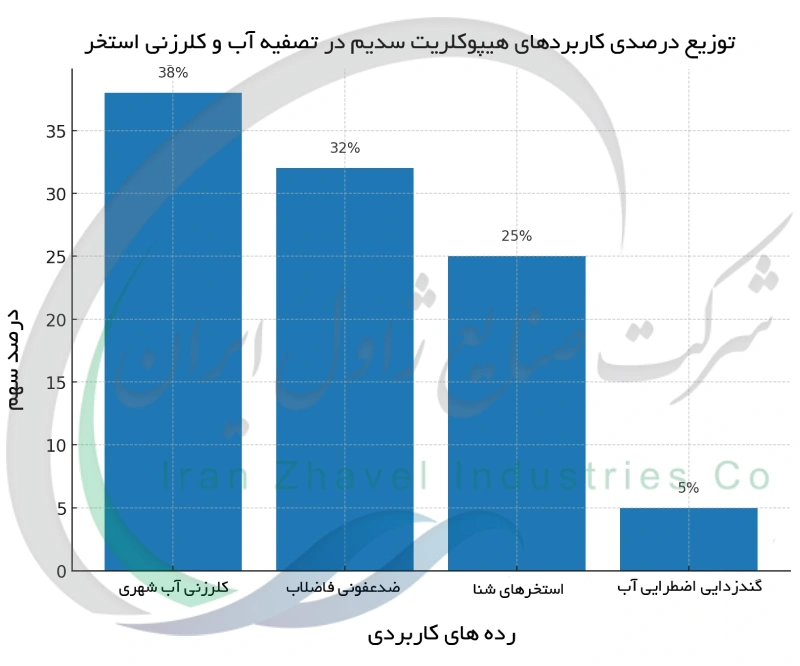
تصفیه آب و کلرزنی استخرها
هیپوکلریت سدیم نقشی حیاتی در سالم سازی آب آشامیدنی و آب استخرهای شنا دارد. بسیاری از سامانه های تأمین آب شهری از محلول های هیپوکلریت سدیم برای کلرزنی آب استفاده می کنند تا میکروارگانیسم های مضر را از بین ببرند و مقداری کلر آزاد باقیمانده در شبکه توزیع فراهم کنند. استفاده از سفیدکننده مایع برای گندزدایی آب معمولاً نسبت به کار با گاز کلر ایمن تر و آسان تر است، مخصوصاً برای سیستم های کوچکتر یا مناطق روستایی. در استخرهای شنا هیپوکلریت سدیم (که معمولاً کلر مایع نامیده می شود) به صورت منظم به آب افزوده می شود تا رشد جلبک ها و پاتوژن ها کنترل شده و آب پاکیزه و زلال بماند. وایتکس در آب ، کلر آزاد (هیپوکلروس اسید) آزاد می کند که انواع باکتری ، ویروس و جلبک را از بین می برد. اپراتورهای استخر باید سطوح کلر و pH آب را زیر نظر داشته باشند، چون هیپوکلریت باعث افزایش pH آب می شود ؛ برای متعادل نگه داشتن شیمی آب استخر اغلب از اسیدها یا روش های دیگر برای کاهش pH استفاده می شود. نور خورشید و گرما باعث تخریب و تبخیر سریع کلر در آب می شوند و به همین دلیل استخرهای روباز و گرم مصرف هیپوکلریت بیشتری دارند و گاهی از تثبیت کننده ها برای ماندگاری بیشتر کلر استفاده می شود. در تصفیه فاضلاب از هیپوکلریت سدیم برای ضدعفونی نهایی پساب پیش از رهاسازی آن به محیط استفاده می شود تا میکروب های بیماری زا از بین بروند. البته هر گونه کلر باقیمانده معمولاً قبل از تخلیه پساب به محیط خنثی می شود (با موادی مانند متابی سولفیت سدیم) تا به موجودات آبزی آسیبی نرسد. برای ضدعفونی اضطراری آب آشامیدنی در شرایطی که امکان جوشاندن وجود ندارد می توان از وایتکس خانگی به میزان اندک در هر لیتر آب خام استفاده کرد (چند قطره در هر لیتر) تا عوامل بیماری زا کشته شوند.