فهرست عناوین
نوشته شده توسط شرکت صنایع ژاول ایران
منتشر شده توسط شرکت صنایع ژاول ایران
تاریخ انتشار مقاله : 13-06-1404
تاریخ بروزرسانی مقاله : 13-06-1404
تعداد کلمات : 3200
آدرس مقاله : لینک مقاله
روند تولید آزمایشگاهی آب ژاول

مقدمه
هیپوکلریت سدیم (NaOCl) یک ترکیب شیمیایی است که به طور عام به عنوان سفیدکننده (آب ژاول) شناخته می شود و به خاطر خواص گندزدایی و سفیدکنندگی قوی خود ارزشمند است. در صنایع هیپوکلریت سدیم در مقادیر زیاد تولید می شود، اما می توان آن را در مقیاس آزمایشگاهی نیز از طریق واکنش های شیمیایی کنترل شده تهیه کرد. درک فرآیند تولید آزمایشگاهی هیپوکلریت سدیم برای شیمی دانان و تکنسین هایی که به دسته های کوچک از این ماده مفید برای پژوهش یا اهداف بهداشتی نیاز دارند ضروری است.
آشنایی با هیپوکلریت سدیم
هیپوکلریت سدیم یک ترکیب معدنی با فرمول شیمیایی NaOCl است که از کاتیون سدیم و آنیون هیپوکلریت تشکیل شده است. این ترکیب در حالت خالص بسیار ناپایدار است و معمولاً به شکل محلول رقیق آبی یافت می شود. هیپوکلریت سدیم به عنوان ماده ی فعال موجود در سفیدکننده ی مایع شناخته می شود؛ سفیدکننده به صورت محلولی شفاف با رنگ زرد مایل به سبز کم رنگ و بوی تند کلر ظاهر می گردد. جرم مولکولی هیپوکلریت سدیم حدود ۷۴٫۴۴ گرم بر مول است و در آب عمدتاً به یون هیپوکلریت (OCl^-) تفکیک می شود. محلول های هیپوکلریت سدیم به شدت قلیایی هستند حدود pH ۱۲ زیرا این ترکیب در شرایط بازی پایدارترین حالت را دارد؛ در محیط خنثی یا اسیدی تجزیه شده و گاز کلر آزاد می کند. بخش زیادی از قدرت سفیدکنندگی و ضدعفونی کنندگی این ماده ناشی از تولید اسید هیپوکلروس (HOCl) در آب هنگام رقیق شدن یا کمی اسیدی شدن محلول است، زیرا HOCl یک اکسیدکننده ی قوی است که رنگدانه ها و اجزای سلولی میکروب ها را تخریب می کند. هیپوکلریت سدیم گونه ی شیمیایی نسبتاً واکنش پذیری است و به مرور زمان به ویژه در معرض گرما، نور یا آلاینده ها تجزیه می شود. آشنایی با ویژگی های بنیادی هیپوکلریت سدیم مانند واکنش پذیری و ناپایداری آن در برابر حرارت یا نور، پیش از اقدام به تولید یا کار با آن در محیط آزمایشگاه ضروری است.
کاربردها و اهمیت هیپوکلریت سدیم
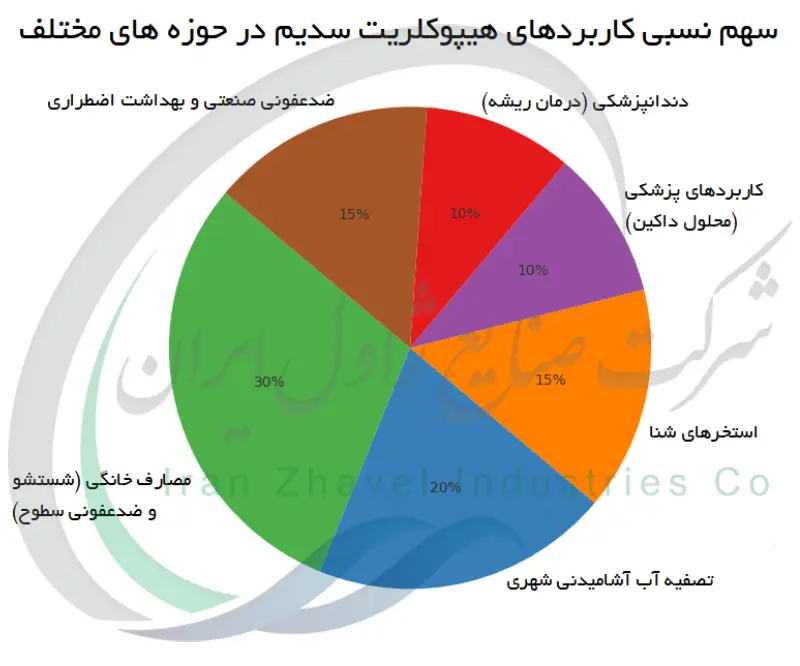
هیپوکلریت سدیم به دلیل کاربردهای متنوع و نقش مهمی که در حفظ بهداشت و ایمنی دارد، در سراسر جهان شناخته شده است. در مصارف خانگی از آن به عنوان سفیدکننده برای سفید کردن لباس ها و از بین بردن لکه ها استفاده می شود و نیز به عنوان یک گندزدا برای ضدعفونی سطوح آشپزخانه، حمام و کف ها به کار می رود. تأسیسات تصفیه ی آب شهری برای حذف پاتوژن ها (بیماری زاها) از منابع آب آشامیدنی و نیز در استخرهای شنا به هیپوکلریت سدیم وابسته هستند. در همین راستا بسیاری از صنایع و مصرف کنندگان به دنبال خرید آب ژاول کلران سمنان بشکه 220 لیتری هستند تا از یک محصول استاندارد و قابل اعتماد برای مصارف ضدعفونی بهره مند شوند.در محیط های درمانی و آزمایشگاهی، محلول های رقیق شده ی سفیدکننده برای استریل کردن تجهیزات و سطوح کاری استفاده می شوند و به جلوگیری از انتشار عفونت ها کمک می کنند. در واقع، سفیدکننده ی خانگی معمولاً حاوی حدود ۵٪ هیپوکلریت سدیم است، در حالی که انواع غلیظ تر (تا ۱۰ تا ۱۵٪) آن در ضدعفونی صنعتی و گندزدایی استخرها به کار می روند. در حوزه ی پزشکی نیز برای این ماده کاربردهایی یافته شده است: محلول رقیقی با نام محلول داکین (حدود ۰٫۵٪ هیپوکلریت سدیم) برای شستشوی زخم ها به کار می رود و دندان پزشکان از هیپوکلریت سدیم در طی درمان ریشه ی دندان برای حل کردن بافت های مرده و ضدعفونی کانال دندان استفاده می کنند. هیپوکلریت سدیم در بهداشت اضطراری نیز نقش مهمی ایفا می کنند؛ برای مثال در ضدعفونی آب پس از بلایای طبیعی یا شیوع بیماری ها. فعالیت ضد میکروبی گسترده و سهولت نسبی استفاده از آن، این ماده را به یک ماده ی شیمیایی ضروری در دنیای مدرن تبدیل کرده است.
پیشینه تاریخی تولید هیپوکلریت سدیم
تاریخچه ی تولید هیپوکلریت سدیم به اواخر قرن هجدهم و اوایل قرن نوزدهم بازمی گردد. در سال ۱۷۸۹، شیمیدان فرانسوی کلود لویی برتوله برای اولین بار با عبور دادن گاز کلر از درون محلول قلیاب پتاس (پتاسیم هیدروکسید) در آزمایشگاه خود در پاریس محلول هیپوکلریت تولید کرد. حاصل این واکنش یک محلول رقیق هیپوکلریت پتاسیم بود که به آب ژاول شهرت یافت (نام محله ی ژاول که آزمایشگاه او در آنجا بود). چند دهه بعد در حدود سال ۱۸۲۰، آنتوان لاباراک این فرآیند را بهبود بخشید؛ او به جای پتاس از سود سوزآور ارزان تر (محلول قلیایی سدیم) استفاده کرد و محلولی به دست آورد که به محلول لاباراک مشهور شد (عملاً همان هیپوکلریت سدیم). این آماده سازی های اولیه در مقیاس آزمایشگاهی، خواص سفیدکنندگی و گندزدایی قوی محلول های هیپوکلریت را نشان دادند. در همین دوره بود که دانشمندان برای توضیح بهتر ویژگی ها و کاربردها به معرفی فرمول مولکولی و ساختار هیپوکلریت سدیم پرداختند تا ماهیت علمی و شیمیایی آن نیز روشن تر شود. این موفقیت در فرآیندهای آزمایشگاهی بعدها به تولید در مقیاس بزرگ تر و در دسترس قرار گرفتن گسترده ی سفیدکننده برای مصارف صنعتی و خانگی در قرن نوزدهم انجامید. محلول های هیپوکلریت به سرعت به دلیل توانایی شان در زدودن لکه ها و رفع بوی تعفن ناشی از فساد شناخته شدند. به ویژه محلول لاباراک در دهه ی ۱۸۲۰ به عنوان یک ضدعفونی کننده در بیمارستان ها و سردخانه ها به کار گرفته شد. کار پیشگامانه ی برتوله و لاباراک در آزمایشگاه، پایه گذار تولید سفیدکننده در مقیاس صنعتی و کاربرد ترکیبات کلردار در بهداشت و سلامت عمومی بود.
تولید آزمایشگاهی در برابر تولید صنعتی
روش های تولید هیپوکلریت سدیم در آزمایشگاه از بسیاری جهات با روش های تولید صنعتی آن تفاوت های چشمگیری دارد. تولید آزمایشگاهی معمولاً یک فرآیند بچ (ناپیوسته) در مقیاس کوچک است که به شیمیدان اجازه می دهد تنها مقدار مورد نیاز برای آزمایش ها یا ضدعفونی را تهیه کند. در روش آزمایشگاهی ممکن است گاز کلر در همان محل واکنش تولید شود یا از سیلندر گاز کلر فشرده استفاده گردد و سپس به صورت حباب درون محلول سدیم هیدروکسید تزریق شود تا واکنش تحت شرایط کنترل شده انجام گیرد. در مقابل تأسیسات صنعتی اغلب سفیدکننده را با یک فرآیند پیوسته تولید می کند که طی آن کلر و سدیم هیدروکسید (هر دو حاصل از فرآیند کلر-قلیا در مقیاس بزرگ) در راکتورهای بزرگ مجهز به سیستم های خنک کننده واکنش می دهند. فرآیندهای صنعتی دما، غلظت و میزان اختلاط را با دقت تنظیم می کنند تا بیشترین بازده و کمترین ناخالصی هایی مانند کلرات به دست آید. علاوه بر این تولید صنعتی محلول هایی با غلظت بالاتر معمولاً تا ۱۲–۱۵٪ وزنی NaOCl را نتیجه می دهد که سپس برای کاربردهای تجاری و خانگی رقیق یا تنظیم می شوند. با وجود تفاوت در مقیاس و تجهیزات، شیمی بنیادین واکنش یکسان است و درس هایی از تجربیات تولید صنعتی مانند کنترل دما در آزمایشگاه نیز به کار گرفته می شود تا محصول با کیفیت حاصل گردد.
شیمی تشکیل هیپوکلریت سدیم
تولید هیپوکلریت سدیم بر یک واکنش شیمیایی ساده استوار است. در مسیر سنتز اصلی، گاز کلر (Cl2) را به درون یک محلول سدیم هیدروکسید (NaOH) وارد می کنند که نتیجه ی آن تشکیل هیپوکلریت سدیم (NaOCl), به همراه سدیم کلرید (NaCl) و آب است. معادله ی واکنش به صورت زیر ساده می شود : Cl2 + 2 NaOH → NaOCl + NaCl + H2O این واکنش نمونه ی کلاسیکی از یک واکنش خوداکسایش-کاهش است؛ به این معنی که مولکول کلر به طور همزمان دچار اکسایش و کاهش می شود: یک اتم کلر کاهش یافته و به یون کلرید Cl^- تبدیل می گردد و اتم دیگر اکسید شده و یون هیپوکلریت (ClO^-) را ایجاد می کند. این فرآیند معمولاً نیاز دارد که مقدار اضافی NaOH و دمای پایین حفظ شود تا واکنش به سمت تشکیل هیپوکلریت پیش رود و واکنش های جانبی مهار شوند. اگر شرایط بهینه نباشد (برای مثال اگر محلول بیش از حد گرم شود یا به اندازه ی کافی قلیایی نباشد)، بخشی از هیپوکلریت می تواند بیشتر واکنش داده و کلرات ناخواسته (ClO3^-) تولید کند یا با تجزیه، گاز اکسیژن آزاد نماید. درک این شیمی واکنش بسیار مهم است تا فعالان آزمایشگاه بتوانند هنگام تولید هیپوکلریت سدیم بازده و خلوص را بهینه کنند.
مواد و واکنشگرهای مورد نیاز
تهیه ی هیپوکلریت سدیم در آزمایشگاه به چند ماده و واکنشگر کلیدی نیاز دارد. واکنشگرهای اصلی عبارتند از کلر و سدیم هیدروکسید. گاز کلر (Cl2) معمولاً استفاده می شود؛ می توان آن را از سیلندر گاز فشرده تأمین کرد یا در همان محل از طریق یک واکنش شیمیایی تولید نمود برای مثال با واکنش دادن اسید هیدروکلریک با یک اکسیدکننده مانند پرمنگنات پتاسیم می توان Cl2 تولید کرد. سدیم هیدروکسید (NaOH) به شکل محلول آبی مورد نیاز است؛ یک محلول سرد و رقیق با استفاده از آب مقطر تهیه می شود. غلظت NaOH می تواند متفاوت باشد، اما یک رویه ی آزمایشگاهی رایج استفاده از محلولی در حدود ۵–۱۰٪ (وزنی/حجمی) برای ایجاد شرایط کنترل شده است. مهم است که مقداری NaOH بیشتر از مقدار استوکیومتری در محیط وجود داشته باشد تا محلول در طی واکنش و پس از آن حالت قلیایی خود را حفظ کند. سایر مواد مورد نیاز شامل یخ برای خنک کردن مخلوط واکنش و کاغذهای pH یا pH متر برای اطمینان از بازی بودن قوی محلول نهایی است. همه ی مواد شیمیایی باید از خلوص مناسب برخوردار باشند (به ویژه آبی که فاقد یون های فلزی باشد) تا از وقوع واکنش های جانبی یا تجزیه ی زودرس محصول جلوگیری شود.
تجهیزات و تنظیمات لازم برای تولید آزمایشگاهی
راه اندازی تجهیزات مناسب برای تولید هیپوکلریت سدیم در مقیاس آزمایشگاهی به منظور ایمنی بسیار مهم است. این واکنش معمولاً در یک ظرف شیشه ای واکنش (ارلن یا بالن) انجام می شود که در برابر مواد خورنده مقاومت داشته باشد. برای مثال یک پیکربندی متداول از دو ظرف استفاده می کند: یک ظرف برای تولید گاز کلر (اگر از سیلندر آماده استفاده نشود) و ظرف دیگر که حاوی محلول سرد سدیم هیدروکسید است تا کلر را جذب کند. ظرف تولید کلر ممکن است به یک قیف قطره ای مجهز باشد تا به کمک آن اسید به یک نمک کلرید یا عامل تولیدکننده ی کلر اضافه شود؛ این ظرف از طریق لوله ی گاز به یک لوله ی ورودی که درون محلول NaOH ظرف دوم غوطه ور است متصل می گردد. ظرف جذب کننده روی یک حمام یخ قرار داده می شود تا دمای آن پایین نگه داشته شود. این ظرف همچنین باید دارای یک خروجی یا لوله ی دوم متصل به محلول جاذب مانند یک تله حاوی NaOH یا آب باشد تا هرگونه کلر اضافی پیش از رهایی در هوا به دام بیفتد. تمام اتصالات باید محکم باشند و از شیلنگ های لاستیکی یا تفلونی که در برابر کلر مقاومند استفاده شود. یک همزن مغناطیسی یا مکانیزم تکان دهنده در ظرف جذب می تواند به پراکندگی و واکنش بهتر گاز کمک کند. کل این مجموعه باید به دلیل ماهیت سمی گاز کلر در هود آزمایشگاهی یا یک محیط با تهویه ی مناسب قرار داده شود.
مراحل گام به گام سنتز آزمایشگاهی
سنتز هیپوکلریت سدیم در آزمایشگاه به صورت مرحله به مرحله و تحت شرایط کنترل شده انجام می شود. ابتدا شیمی دان یک محلول سرد و رقیق سدیم هیدروکسید را در ظرف جذب (بالن یا بشر) آماده می کند برای مثال مقدار مورد نیاز NaOH را در آب حل کرده و ظرف را در حمام یخ قرار می دهد. هم زمان منبع کلر آماده می شود: اگر از سیلندر گاز استفاده شود، شدت جریان گاز را بسیار کم تنظیم می کنند؛ اگر کلر به طور شیمیایی تولید می شود، واکنشگرها در یک ظرف جداگانه مهیا می شوند که لوله ی انتقال گاز آن به درون محلول NaOH در ظرف اصلی وارد شده است. در مرحله ی بعد گاز کلر به آرامی وارد محلول قلیایی می شود. محلول به طور مداوم هم زده می شود تا عبور گاز و جذب آن به حداکثر برسد. دمای مخلوط به دقت پایش می شود و برای پایین نگه داشتن آن در صورت لزوم به حمام یخ یخ اضافه می گردد تا مخلوط زیر دمای اتاق بماند. با پیشرفت واکنش، تشکیل هیپوکلریت سدیم ممکن است با بوی ملایم کلر بالای محلول و رنگ زرد مایل به سبز روشن نمایان شود. پس از اضافه شدن مقدار محاسبه شده ی کلر یا زمانی که NaOH تقریباً مصرف شده ولی اندکی قلیا هنوز باقی است، ورود کلر را متوقف می کنند. محلول اندکی بیشتر هم زده می شود تا اطمینان حاصل گردد که واکنش به طور کامل انجام شده است. در نهایت محلول هیپوکلریت سدیم حاصل را رها می کنند تا به دمای محیط برسد و سپس آن را به یک بطری نگهداری مناسب (ترجیحاً ظرف پلاستیکی یا شیشه ای کدر با درپوش) منتقل می کنند. تجهیزات استفاده شده شسته می شوند و هر کلر باقی مانده در سیستم با محلول سدیم تیوسولفات یا بی سولفیت خنثی می گردد.
| مرحله | شرح فرآیند | شرایط | مشاهدات | احتیاطات |
|---|---|---|---|---|
| ۱ | محلول سدیم هیدروکسید را در یک فلاسک مناسب آماده کنید (مثلاً NaOH با غلظت ۵–۱۰٪ در آب). این محلول را در حمام یخ سرد کنید. | NaOH کاملاً حل شده باشد؛ حجم محلول طبق نیاز (مثلاً ۵۰۰ میلی لیتر). دما قبل از ورود کلر ۰ تا ۵ درجه ی سانتی گراد باشد. | محلول شفاف است. سرد کردن ممکن است در صورت غلظت خیلی بالا باعث کمی بلور زدن شود (با رقیق سازی مناسب از این امر جلوگیری کنید). | سدیم هیدروکسید خورنده است؛ با احتیاط کار کنید. از ظرف مقاوم در برابر حرارت استفاده کنید (حل کردن NaOH گرمازا است). محلول را سرد کنید تا از نقاط داغ جلوگیری شود. |
| ۲ | دستگاه را در هود آزمایشگاه نصب کنید. منبع گاز کلر (مولد یا سیلندر) را به ظرف واکنش حاوی محلول NaOH وصل کنید. مطمئن شوید خروجی به یک واحد جذب کننده متصل است. | تمام شیشه آلات تمیز و اتصالات محکم باشند. مولد کلر (در صورت استفاده) با مواد شیمیایی شارژ شده ولی هنوز فعال نشده باشد. | دستگاه مونتاژ شده و هیچ نشتی ای مشاهده نمی شود. حمام یخ در اطراف فلاسک NaOH قرار دارد. | تجهیزات ایمنی را بپوشید. از محکم بودن گیره ها و درپوش ها اطمینان حاصل کنید. مطمئن شوید هود روشن است. |
| ۳ | جریان گاز کلر را به آرامی شروع کنید. اگر از مولد استفاده می کنید، با افزودن قطره قطره ی اسید، تولید کلر را آغاز کنید. | ورود کلر با نرخ کنترل شده (حباب های کوچک قابل رؤیت). دما را در طول فرآیند زیر ۱۵ درجه ی سانتی گراد نگه دارید. | حباب های گاز کلر در حال ورود به محلول قلیایی دیده می شوند. در صورت جذب کامل، بوی قابل توجه کلر احساس نمی شود. | گاز کلر را بیش از حد سریع وارد نکنید تا جاذب اشباع نشود. مراقب هرگونه نشت یا فرار گاز باشید. |
| ۴ | به ورود حباب های کلر به محلول ادامه دهید تا مقدار مورد نظر واکنش دهد. برای بهبود جذب، محلول را به آرامی هم بزنید. | مقداری NaOH اضافه در محلول حفظ شود (پH همچنان بالای ۱۱ باقی بماند). دما با افزودن یخ پایین نگه داشته شود. | محلول به تدریج با تشکیل NaOCl به زرد مایل به سبز کم رنگ درمی آید. با نزدیک شدن به پایان واکنش, ممکن است بوی ملایم سفیدکننده (کلر) قابل تشخیص باشد. | به صورت دوره ای پیشرفت واکنش را بررسی کنید. از استنشاق بخارات خودداری کنید. اجازه ندهید دما بالا برود (در صورت نیاز یخ اضافه کنید). |
| ۵ | واکنش را زیر نظر داشته باشید و در نقطه ی مناسب ورود کلر را متوقف کنید. این زمان ممکن است زمانی باشد که بوی خفیف کلر پایدار می ماند یا پس از افزودن حجم محاسبه شده ی کلر. | مدت زمان واکنش بسته به مقیاس می تواند از چند دقیقه تا چند ساعت باشد. اطمینان حاصل کنید در پایان مقداری NaOH واکنش نداده باقی مانده است (محلول همچنان خاصیت قلیایی دارد). | واکنش زمانی کامل است که افزودن کلر بیشتر, دیگر غلظت هیپوکلریت را افزایش نمی دهد (محلول به حالت اشباع رسیده) یا پH شروع به افت می کند. | هرگز واکنش را تا نقطه ی اسیدی ادامه ندهید. اگر بوی کلر شدید شد، نشان دهنده ی کلر اضافی است و باید جریان گاز را متوقف کنید. |
| ۶ | منبع کلر را جدا یا خاموش کنید. اجازه دهید محلول مدت کوتاهی بماند و هم زده شود تا تمام کلر مصرف گردد. | دیگر هیچ کلری وارد نمی شود. محلول هنوز سرد است. برای چند دقیقه ی دیگر به هم زدن ادامه دهید. | هر کلر باقی مانده در محلول واکنش می دهد و از بین می رود. محلول ممکن است زرد کم رنگ باشد. اکنون هیچ حباب گازی مشاهده نمی شود. | سیلندر گاز را ببندید یا مواد مولد کلر را به صورت ایمن خنثی کنید. فلاسک را برای مدتی درون هود نگه دارید تا بخارات باقی مانده تخلیه شوند. |
| ۷ | (در صورت لزوم) محلول را صاف کنید تا هرگونه جامد یا رسوب (مانند نمک یا محصولات فرعی) جدا شود. این گام معمولاً فقط برای تهیه های با غلظت بالا ضروری است. | اگر کریستال های نمک تشکیل شده اند، از یک صافی با منافذ درشت یا پارچه استفاده کنید. معمولاً برای محلول های رقیق نیازی به فیلتراسیون نیست. | محلول نهایی یک مایع زرد بسیار کمرنگ و شفاف است (بدون ذرات معلق). بازده NaOCl در این حالت حداکثر است. | اطمینان یابید که دستگاه صافی تمیز و مقاوم در برابر خوردگی است. از تماس محلول با پوست اجتناب کنید. |
| ۸ | محلول هیپوکلریت سدیم را به ظرف ذخیره منتقل کنید. روی آن برچسب غلظت و تاریخ بزنید. به طور صحیح نگهداری کنید. دستگاه ها و ظروف را تمیز کنید. | از بطری پلاستیکی یا شیشه ای تیره با درپوش محکم استفاده کنید. در جای خنک و تاریک نگهداری کنید. | محصول آماده ی استفاده است. به مرور زمان، به ویژه اگر در معرض گرما یا نور قرار گیرد، آرام آرام از قدرت آن کاسته می شود. | روی ظرف به طور واضح «هیپوکلریت سدیم» (سفیدکننده) و علائم هشداردهنده را درج کنید. تمام شیشه آلات را کاملاً شستشو دهید و هرگونه کلر یا سدیم هیدروکسید باقی مانده را پیش از دور ریختن خنثی کنید. |
کنترل شرایط واکنش
دستیابی به بازده بالای هیپوکلریت سدیم با حداقل ناخالصی ها نیازمند کنترل دقیق شرایط واکنش است. کنترل دما به ویژه اهمیت دارد: مخلوط واکنش باید تا حد امکان خنک نگه داشته شود (معمولاً زیر ۲۰ درجه ی سانتی گراد) تا حلالیت کلر در محلول بیشتر شود و از واکنش های جانبی مانند تشکیل سدیم کلرات جلوگیری گردد. استفاده از حمام یخ و افزودن کلر به آرامی به مدیریت دما کمک می کند. غلظت نیز یک عامل کلیدی است؛ برای این واکنش از محلول NaOH نسبتاً رقیق استفاده می شود زیرا سود بسیار غلیظ می تواند به رسوب نمک منجر شود و محلول بیش از حد رقیق نیز محلول سفیدکننده با غلظت بسیار پایین تولید می کند. نگه داشتن مقدار اضافی NaOH در طول فرآیند باعث می شود محیط واکنش همواره قلیایی بماند. اگر NaOH به طور کامل مصرف شود، محلول به صورت موضعی اسیدی خواهد شد و کلر اضافه بعدی به جای تشکیل هیپوکلریت بیشتر، محصولات ناخواسته تولید می کند (و گاز کلر خطرناک آزاد می شود). هم زدن یا تکان دادن محلول تماس بین گاز کلر و مایع را افزایش می دهد و جذب را بهبود می بخشد. با کنترل این پارامترها دما، غلظت، pH، و نرخ افزودن فرآیند آزمایشگاهی می تواند هیپوکلریت سدیم را با غلظت مورد نظر و حداقل پسماند یا خطر تولید کند.
کیفیت و غلظت محصول
پس از آماده شدن محلول هیپوکلریت سدیم ارزیابی کیفیت و غلظت آن گام مهم بعدی است. غلظت محصول اغلب بر حسب درصد کلر فعال (مقدار موثر کلر موجود) یا بر حسب گرم در لیتر NaOCl بیان می شود. محلول حاصل معمولاً دارای حدود ۵–۱۰٪ کلر فعال هستند وقتی به صورت بچ آزمایشگاهی تولید می شود، هرچند مقدار دقیق آن به میزان کلر جذب شده و غلظت اولیه ی NaOH بستگی دارد. برای تعیین این کمیت، شیمی دانان معمولاً یک تیترسنجی یدومتری انجام می دهند: حجم معینی از محلول سفیدکننده را با پتاسیم یدید مخلوط می کنند که با NaOCl واکنش داده و ید آزاد می کند, و سپس ید آزاد شده را با تیوسولفات سدیم تیتر می کنند تا محلول بی رنگ شود. این کار اجازه ی محاسبه ی غلظت هیپوکلریت را می دهد. جدا از غلظت، محلول باید شفاف (عاری از هرگونه جامد حل نشده) و به شدت قلیایی باشد. باقی ماندن اندکی سدیم هیدروکسید اضافی در مخلوط نهایی طبیعی و حتی برای پایداری مطلوب است. حضور سدیم کلرید به عنوان محصول جانبی تاثیری بر قدرت گندزدایی سفیدکننده ندارد و صرفاً بخشی از ترکیب کلی محلول است.




