فهرست عناوین
- مقدمه
- شناخت محلول هیپوکلریت سدیم
- چرا محلول های هیپوکلریت سدیم بسیار قلیایی هستند
- بازه pH معمول در محصولات سفیدکننده تجاری
- تعادل هیپوکلریت در آب وابسته به pH
- نقش اسید هیپوکلروس (HOCl) در برابر یون هیپوکلریت (OCl⁻)
- pH بهینه برای قدرت ضدعفونی
- اثر pHهای مختلف بر توان سفیدکنندگی
- پایداری و عمر مفید: نقش pH
- محصولات تجزیه در سطوح مختلف pH
- ماهیت خورنده و اثرات pH بر مواد
- بررسی مقایسه ای خواص هیپوکلریت در pHهای مختلف
نوشته شده توسط شرکت صنایع ژاول ایران
منتشر شده توسط شرکت صنایع ژاول ایران
تاریخ انتشار مقاله : 24-06-1404
تاریخ بروزرسانی مقاله : 24-06-1404
تعداد کلمات : 2800
آدرس مقاله : لینک مقاله
PH محلول آب ژاول و تاثیر آن بر خواص ماده

مقدمه
محلول هیپوکلریت سدیم که به طور عمومی با نام سفیدکننده (آب ژاول) شناخته می شود، یک عامل ضدعفونی کننده و سفید کننده بسیار پرکاربرد است. این محلول دارای pH به شدت قلیایی (معمولاً حدود ۱۱ تا ۱۳) است. pH این محلول تأثیر قابل توجهی بر رفتار شیمیایی، پایداری و اثربخشی آن دارد. در واقع قلیاییت بالای سفیدکننده در طول فرایند تولید عمداً حفظ می شود تا ترکیب کلر فعال در محلول پایدار بماند. درک نحوه تأثیر pH بر خواص هیپوکلریت سدیم برای استفاده ایمن و مؤثر از آن حیاتی است. از توان نیرومند میکروب کشی آن گرفته تا طول عمر و خاصیت خورندگی اش، بسیاری از ویژگی های کلیدی این ماده مستقیماً با سطح pH آن مرتبط هستند. به همین دلیل است که هنگام خرید آب ژاول کلران سمنان گالن 20 لیتری یا سایر انواع تجاری این ترکیب، توجه به میزان pH و کیفیت محلول اهمیت ویژه ای پیدا می کند.در بخش های بعد بررسی می کنیم که چگونه pH محلول هیپوکلریت سدیم بر جنبه های مختلف خواص و عملکرد این ماده اثر می گذارد.
شناخت محلول هیپوکلریت سدیم
محلول های هیپوکلریت سدیم یک ترکیب شیمیایی با فرمول NaOCl است که معمولاً به صورت مایع زرد مایل به سبز کم رنگ دیده می شود. این ماده جزء موثر اصلی سفیدکننده های کلری بوده و قرن ها است که به عنوان ماده ضدعفونی کننده و سفیدکننده پارچه به کار می رود. در آب، هیپوکلریت سدیم به کاتیون های سدیم (Na+) و آنیون های هیپوکلریت (OCl−) تفکیک می شود. محلول های سفیدکننده تجاری معمولاً حدود ۵ تا ۱۵ درصد وزنی NaOCl به همراه آب و مقدار کمی سدیم هیدروکسید دارند. این محلول بوی مشخص کلر دارد و خواص اکسیدکنندگی قوی از خود نشان می دهد. یکی از ویژگی های قابل توجه آن ماهیت به شدت بازی آن است؛ محلول تازه هیپوکلریت سدیم pH بسیار بالایی دارد. این خاصیت بازی نه تنها بسیاری از ویژگی های آن را تعیین می کند، بلکه ناشی از نحوه تولید و پایدارسازی این محلول نیز هست. در همین راستا، روند تولید آزمایشگاهی آب ژاول اهمیت ویژه ای در درک ساختار، ویژگی ها و پایداری این ماده دارد. کاربردهای هیپوکلریت سدیم از تصفیه آب آشامیدنی گرفته تا ضدعفونی کردن سطوح را شامل می شود. این اکسیدکننده قوی باکتری ها، ویروس ها و قارچ ها را از بین می برد و نقشی کلیدی در بهداشت و کنترل عفونت دارد. همچنین به عنوان عامل سفیدکننده عمل کرده و لکه های سرسخت را برطرف می کند و در شستشوی البسه باعث سفید شدن پارچه ها می شود. چه برای گندزدایی و چه برای لکه بری استفاده شود، ماهیت بنیادی هیپوکلریت سدیم تغییر نمی کند این محلول ذاتاً ناپایدار است و باید با دقت به ویژه از نظر pH مدیریت شود.
چرا محلول های هیپوکلریت سدیم بسیار قلیایی هستند
فرایند تولید هیپوکلریت سدیم به گونه ای است که محلول حاصل ذاتاً بسیار قلیایی می شود. در این فرایند گاز کلر را با محلول سدیم هیدروکسید واکنش می دهند تا هیپوکلریت سدیم تولید شود و کلرید سدیم نیز به عنوان محصول جانبی تشکیل گردد. این واکنش معمولاً به صورت کنترل شده انجام می گیرد تا مقدار اندکی سود سوزآور اضافی در محصول نهایی باقی بماند. در نتیجه سفیدکننده خانگی (وایتکس) با pH حدود ۱۲ یا حتی بیشتر به دست می آید. pH بالا تصادفی نیست به طور عمدی در سطح بالا نگه داشته می شود زیرا یون هیپوکلریت در شرایط قلیایی پایدارتر است. در محلول بسیار قلیایی تمایل هیپوکلریت سدیم به تجزیه شدن به شدت کاهش می یابد. در واقع سود اضافی موجود در سفیدکننده مانند بافری در برابر اسیدی شدن عمل می کند و محلول را در حالتی نگه می دارد که ماده موثره برای مدت طولانی تری دست نخورده باقی بماند. به همین دلیل است که سفیدکننده همیشه به صورت محلولی با pH بالا نگهداری و عرضه می شود. برای مثال واکنش دادن گاز کلر با سدیم هیدروکسید موجب تولید NaOCl شده و مقداری NaOH مصرف نشده (حدود ۰٫۵٪ وزنی) را در محلول باقی می گذارد. این قلیای اضافی باعث می شود pH محلول بالا بماند و از تشکیل هر گونه اسیدی که منجر تجزیه هیپوکلریت شود جلوگیری گردد. بدون چنین pH بالایی، هیپوکلریت سدیم بسیار سریع تر تجزیه شده و محتوای کلر مؤثر خود را از دست می داد.
بازه pH معمول در محصولات سفیدکننده تجاری
محصولات سفیدکننده موجود در بازار دارای pH بسیار بالا (معمولاً در محدوده ۱۱ تا ۱۳) هستند. سفیدکننده خانگی استاندارد (با حدود ۵ تا ۶٪ هیپوکلریت سدیم) اغلب pH تقریبا ۱۲٫۵ دارد. محلول های غلیظ تر (مثلاً هیپوکلریت ۱۰ تا ۱۵٪) می توانند به pH حدود ۱۳ برسند. چنین pH بالایی باعث می شود سفیدکننده به عنوان یک ماده به شدت قلیایی و خورنده طبقه بندی شود. برای مقایسه سفیدکننده با pH ~۱۲٫۵ حدود یک میلیون برابر از آب خنثی (pH 7) قلیایی تر است. اگر نوار آزمون pH را در سفیدکننده فرو ببرید به رنگ بنفش پررنگ در می آید که گواه شدت قلیاییت آن است. این pH بسیار زیاد دلیل احساس لیزی (شبیه صابون) سفیدکننده روی پوست است زیرا چربی های پوست را حل کرده و صابونی می کند و همچنین علت ضرورت احتیاط هنگام کار با این ماده رایج است.
تعادل هیپوکلریت در آب وابسته به pH
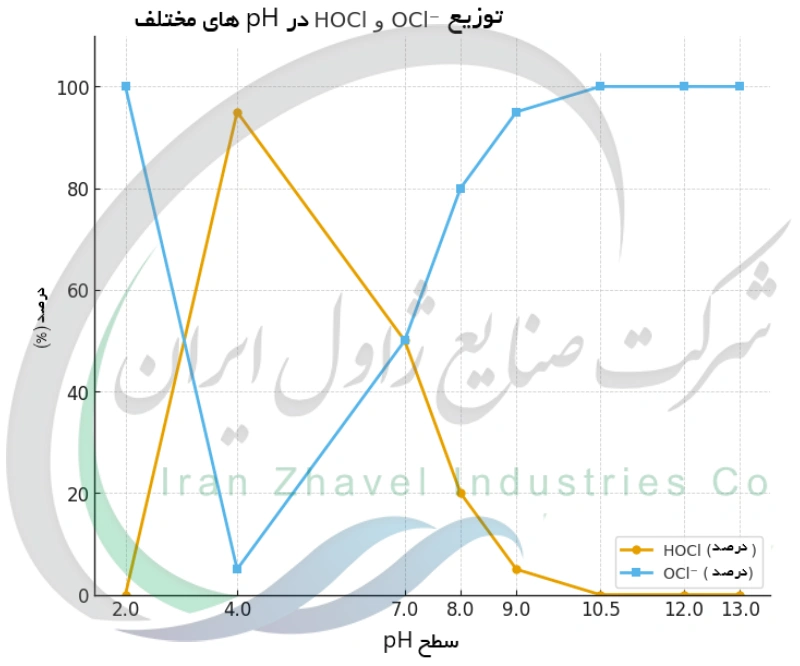
هنگامی که هیپوکلریت سدیم در آب حل می شود، نوعی تعادل شیمیایی وابسته به pH برقرار می گردد. یون هیپوکلریت (OCl⁻) با مولکول های آب واکنش داده و اسید هیپوکلروس (HOCl) و یون هیدروکسید (OH⁻) تولید می کند: OCl⁻ + H₂O ⇌ HOCl + OH⁻. وجود یون هیدروکسید حاصل، محلول را قلیایی می کند. نسبت میان HOCl یک اسید ضعیف با pKa حدود ۷٫۵ و OCl⁻ به شدت به pH بستگی دارد. در pH بالاتر از ~۷٫۵، هیپوکلریت (OCl⁻) گونه غالب است، در حالی که در pH پایین تر از ~۷٫۵، مقدار بیشتری HOCl تشکیل می شود. به بیان دیگر در محلول بسیار بازی تقریباً تمام کلر به صورت OCl⁻ وجود دارد، در حالی که در محلول نزدیک به خنثی یا اسیدی، بخش قابل توجهی از کلر به صورت HOCl و حتی Cl₂ در pH کمتر از ۲ حاضر است. بنابراین pH مشخص می کند که کلر فعال موجود در محلول به چه شکلی حضور داشته باشد.
نقش اسید هیپوکلروس (HOCl) در برابر یون هیپوکلریت (OCl⁻)
دو گونه کلردار در محلول سفیدکننده اسید هیپوکلروس (HOCl) و یون هیپوکلریت (OCl⁻) خواص متفاوتی دارند و نسبت آنها توسط pH محلول تعیین می شود. HOCl خنثی و یک اکسیدکننده بسیار قوی است، در حالی که OCl⁻ دارای بار منفی بوده و علی رغم قدرت اکسیدکنندگی، کندتر عمل می کند. در pH بسیار بالا (محیط شدیداً قلیایی)، OCl⁻ گونه تقریباً غالب است و HOCl تقریباً وجود ندارد. در pH پایین تر (نزدیک به خنثی)، بخش بزرگتری از کلر به صورت HOCl در می آید. مثلاً در pH حدود ۷٫۵، تقریباً نیمی از کلر به شکل HOCl و نیمی به صورت OCl⁻ حضور دارند. این توازن اهمیت زیادی دارد زیرا HOCl در کشتن میکروب ها تا حدود ۸۰ برابر موثرتر از OCl⁻ است. مولکول بدون بار HOCl به راحتی از دیواره سلولی میکروب ها عبور می کند و سریع واکنش می دهد، در حالی که یون OCl⁻ (با بار منفی) کندتر اثر می کند. بنابراین تغییر pH و نسبت HOCl به OCl⁻ مستقیماً کارایی و برخی ویژگی های محلول سفیدکننده را تحت تأثیر قرار می دهد. در عمل، یک محلول با pH ۶ محتوی عمدتاً HOCl می تواند بسیار سریع تر میکروب ها را نابود کند، در حالی که محلولی با pH ۹ محتوی عمدتاً OCl⁻ برای دستیابی به همان سطح گندزدایی به زمان تماس طولانی تری نیاز دارد.
pH بهینه برای قدرت ضدعفونی
از آنجا که HOCl شکل بسیار قوی تر ماده ضدعفونی کننده است، محلول هیپوکلریت سدیم بالاترین توان گندزدایی خود را در pH کمی اسیدی تا خنثی نشان می دهد. در واقع هنگامی که از سفیدکننده برای ضدعفونی آب آشامیدنی یا استخر استفاده می شود، اثرگذاری آن در pH حدود ۶ تا ۷ حداکثر است زیرا HOCl گونه غالب می شود. برای مثال در استخرهای شنا pH آب را معمولاً در محدوده ۷٫۲ تا ۷٫۶ نگه می دارند چون در این محدوده درصد قابل توجهی از کلر به شکل HOCl باقی می ماند و می تواند به سرعت باکتری ها و جلبک ها را نابود کند. البته محلول سفیدکننده داخل بطری در چنین pH نگهداری نمی شود اگر pH آن نزدیک خنثی بود به سرعت تجزیه می شد. بنابراین آن را در حالت پایدار قلیایی ذخیره می کنند ولی هنگام مصرف به آب افزوده شده و pH محیط استفاده در محل تنظیم می گردد. برخی محصولات ضدعفونی ویژه عملاً محلول های حاوی HOCl هستند با pH تنظیم شده حدود ۵ تا ۶ که حداکثر قدرت میکروب کشی را به طور فوری فراهم می کنند. این محلول ها به دلیل ناپایداری باید بلافاصله پس از تولید مصرف شوند. در مجموع با اینکه برای ذخیره سازی، هیپوکلریت سدیم را در pH بالا نگه می دارند، اما قدرت گندزدایی آن زمانی آشکار می شود که هنگام استفاده pH آن به نزدیک خنثی کاهش یابد.
اثر pHهای مختلف بر توان سفیدکنندگی
هیپوکلریت سدیم علاوه بر ضدعفونی به عنوان سفیدکننده برای از بین بردن لکه ها و رنگ بری نیز استفاده می شود. توان سفیدکنندگی این ماده نیز تا حدی تحت تأثیر pH محلول قرار می گیرد. هیپوکلریت چه به صورت HOCl و چه به صورت OCl⁻ قادر است ترکیبات آلی رنگی را اکسید کرده و بی رنگ نماید. HOCl به عنوان یک اکسیدکننده قوی تر می تواند برخی لکه های سرسخت را سریع تر از بین ببرد. در عمل سفیدکننده های لباس با pH حدود ۱۲ که عمدتاً حاوی OCl⁻ هستند همچنان قدرت سفیدکنندگی بسیار بالایی دارند، چون غلظت کلر فعال در آن ها زیاد است و خاصیت قلیایی شدیدشان نیز با صابونی کردن و حل کردن آلودگی های چرب به تمیز شدن بیشتر کمک می کند. از سوی دیگر یک محلول هیپوکلریت با pH پایین تر (نزدیک به خنثی) شاید بتواند برخی لکه ها را حتی سریع تر پاک کند چون HOCl بیشتری دارد، اما چنین محلولی ناپایدار است و ممکن است به بافت پارچه نیز آسیب بیشتری برساند. قابل ذکر است که بعضی الیاف حساس (مثل پشم و ابریشم) در برابر محلولهای سفیدکننده قوی و قلیایی آسیب پذیر هستند؛ به همین دلیل برای چنین مواردی از سفیدکننده های ملایم تر یا غلظت های کمتر هیپوکلریت استفاده می شود.
پایداری و عمر مفید: نقش pH
پایداری محلول هیپوکلریت سدیم بسیار به pH آن وابسته است. در pHهای بالا (بیش از ۱۱)، محلول نسبتاً پایدار باقی می ماند. به همین دلیل است که سفیدکننده تجاری را در حالت بسیار قلیایی تولید می کنند این شرایط سرعت تجزیه کلر فعال را به شدت کاهش می دهد. اگر pH محلول به محدوده پایین (نزدیک به خنثی) برسد، هیپوکلریت خیلی سریع تر شروع به تجزیه می کند. برای مثال یک محلول هیپوکلریت که در pH ~۱۲ نگهداری شود می تواند ماه ها قدرت خود را حفظ کند (به شرط نگهداری در محیط خنک و تاریک). اما اگر pH آن به حدود خنثی افت کند، بخش زیادی از کلر آن ظرف چند روز یا چند هفته از بین خواهد رفت. توصیه می شود محلول سفیدکننده در pH حداقل حدود ۱۰ تا ۱۱ نگهداری شود تا حداکثر پایداری حاصل گردد. یکی از دلایل کاهش اثرگذاری سفیدکننده های کهنه، افت تدریجی pH آن و تشکیل HOCl است. به بیان دیگر با اسیدی تر شدن محلول افت pH، هیپوکلریت بیشتری به HOCl (و سپس به گاز کلر و دیگر محصولات جانبی) تبدیل می شود و قدرت ضدعفونی محلول کاهش می یابد. به طور کلی حفظ محلول در وضعیت شدیداً بازی کلید عمر مفید طولانی تر آن است.
محصولات تجزیه در سطوح مختلف pH
هیپوکلریت سدیم در شرایط مختلف می تواند از راه های گوناگون تجزیه شود و pH در تعیین مسیر تجزیه و محصولات حاصل نقش دارد. در pH بسیار پایین (محیط شدیداً اسیدی)، هیپوکلریت سدیم عمدتاً به گاز کلر (Cl₂) تجزیه می شود که به سرعت از محلول خارج می گردد. در pH نسبتاً اسیدی تا خنثی، روند تجزیه تمایل دارد یون کلرید (Cl⁻) و یون کلرات (ClO₃⁻) تولید کند. یکی از واکنش های خودبه خود در این بازه عبارت است از: 3 OCl⁻ → 2 Cl⁻ + ClO₃⁻. این واکنش با حضور مقداری HOCl در محلول تسریع می شود و حرارت یا کاتالیزورها (مانند یون های فلزی) سرعت آن را بیشتر می کنند. مسیر تجزیه جایگزینی نیز وجود دارد که به ویژه در حضور ناخالصی های فلزی یا در pH های بالاتر رخ می دهد و اکسیژن آزاد می کند: 2 OCl⁻ → 2 Cl⁻ + O₂↑. در حدود pH ۶ تا ۷، سرعت تجزیه هیپوکلریت بیشینه است چون HOCl کافی در محلول حاضر است تا با OCl⁻ واکنش های جانبی انجام دهد از جمله تشکیل واسطه ای مثل Cl₂O . اما در pH بسیار بالا (بالاتر از ۱۰)، تجزیه بسیار آهسته تر رخ می دهد و عمدتاً منجر به تشکیل آهسته یون کلرات در طول زمان می شود؛ در حالی که آزاد شدن گاز کلر تقریباً به صفر می رسد.
ماهیت خورنده و اثرات pH بر مواد
سفیدکننده ماده ای ذاتاً خورنده است و هم pH بسیار بالای آن و هم ترکیبات کلردار آن موجب خورندگی می شوند. در حالت شدیداً قلیایی مثلاً pH بالاتر از ۱۲، سفیدکننده می تواند به بسیاری از فلزات آسیب برساند. برای مثال آلومینیوم در تماس با سفیدکننده به سرعت واکنش می دهد و حتی فولاد ضدزنگ ممکن است در بلند مدت دچار خوردگی یا ترک ناشی از تنش شود (به دلیل تشکیل یون های کلرید). pH بالای سفیدکننده می تواند به پوست و چشم نیز آسیب برساند و باعث سوختگی شیمیایی شود، زیرا پروتئین ها و چربی های بافت را تجزیه می کند (مشابه عملکرد محلول سود سوزآور). اگر محلول سفیدکننده اسیدی شود pH آن کاهش یابد، وجود HOCl و Cl₂ در آن باعث می شود خاصیت خورندگی اش دوچندان شود؛ کلر آزاد و HOCl اسیدی به سرعت با فلزات واکنش داده و می توانند اسید هیدروکلریک تولید کنند که فلزات را می خورد. به همین دلیل مخلوط کردن سفیدکننده با پاک کننده های اسیدی می تواند خیلی سریع به سطوح فلزی آسیب رسانده و بخارات سمی ایجاد کند. پلاستیک هایی مانند پلی اتیلن یا PVC معمولاً در برابر سفیدکننده مقاوم هستند و به همین جهت ظروف نگهداری سفیدکننده را از این مواد می سازند. pH همچنین بر الیاف پارچه تاثیر می گذارد: محلول بسیار قلیایی هیپوکلریت سدیم می تواند الیاف پروتئینی نظیر پشم و ابریشم را تجزیه کرده و تضعیف کند. در مجموع نباید اجازه داد محلول سفیدکننده برای مدت طولانی با سطوح حساس (فلزی یا پارچه ای) در تماس باشد. رعایت دستورالعمل مصرف (رقیق سازی مناسب و آبکشی کامل پس از کاربرد) برای به حداقل رساندن اثرات خورندگی آن ضروری است.
بررسی مقایسه ای خواص هیپوکلریت در pHهای مختلف
خواص محلول هیپوکلریت سدیم در pHهای گوناگون میتواند تفاوتهای بسیار زیادی داشته باشد. در یک سوی طیف شرایط شدیداً اسیدی تقریباً تمام این ماده را به گاز کلر تبدیل میکند؛ در سوی دیگر محیط های شدیداً بازی آن را تقریباً کاملاً به شکل یون هیپوکلریت نگه می دارند. هر محدوده pH با موازنه ای میان قدرت اکسیدکنندگی، پایداری و خطرات همراه است. در pH بسیار پایین (مثلاً اگر سفیدکننده با یک اسید قوی مخلوط شود)، گاز کلر بلافاصله آزاد می شود وضعیتی بسیار خطرناک که عملاً هیچ ماده ضدعفونی مؤثری در محلول باقی نمی گذارد. در محدوده اسیدی ضعیف حدود pH ۴ تا ۵ ، تقریباً تمام کلر به صورت HOCl حضور دارد؛ این شرایط حداکثر قدرت ضد میکروبی را ایجاد می کند اما محلول بسیار ناپایدار است و قابلیت ذخیره سازی ندارد. در pH خنثی (~۷)، ترکیبی از HOCl و OCl⁻ وجود دارد که قدرت ضدعفونی بالا را فراهم می کند، گرچه محلول از نظر پایداری متوسط است. در شرایط کمی بازی pH ۸ تا ۹ ، OCl⁻ غالب می شود؛ قدرت ضدعفونی کمتر نسبت به pH پایین ولی پایداری بیشتر است (این محدوده ای است که در استخرها معمولاً نگه داشته می شود تا اثربخشی مناسب و خوردگی قابل کنترل باشد). در pH بسیار قلیایی (>۱۰)، عملاً تمام کلر به شکل OCl⁻ باقی می ماند که اثربخشی گندزدایی را بسیار کاهش می دهد اما پایداری شیمیایی را به حداکثر می رساند حالت استاندارد سفیدکننده در زمان ذخیره سازی. جدول زیر تفاوت های کلیدی محلول هیپوکلریت را در pHهای مختلف خلاصه می کند:
| سطح pH | گونه غالب کلر | قدرت گندزدایی | پایداری | نکات کلیدی |
|---|---|---|---|---|
| ۲ (بسیار اسیدی) | عمدتاً Cl₂ (گاز کلر) | بسیار بالا (ابتدایی) | عملاً هیچ | به سرعت گاز کلر سمی آزاد میکند؛ برای سفید کردن یا ضدعفونی قابل استفاده نیست. |
| ۴ (اسیدی ضعیف) | عمدتاً HOCl (اسید هیپوکلروس) | بسیار بالا | بسیار پایین | HOCl در حداکثر مقدار است؛ قدرت میکروبکشی بسیار قوی ولی محلول بسیار ناپایدار. |
| ۷ (خنثی) | تقریباً ۵۰٪ HOCl، ۵۰٪ OCl⁻ | بالا | متوسط | توازن HOCl و OCl⁻؛ ضدعفونیکننده موثر، اما محلول با گذشت زمان از قدرتش کاسته میشود. |
| ۸ (کمی قلیایی) | عمدتاً OCl⁻ (~۸۰٪) | متوسط | نسبتاً خوب | بیشتر OCl⁻ با اندکی HOCl؛ معمولاً pH آب استخر در این محدوده نگه داشته میشود تا گندزدایی مناسب و خوردگی قابل کنترل باشد. |
| ۹ (نسبتاً قلیایی) | تقریباً تمام OCl⁻ (>۹۵٪) | پایینتر | زیاد | HOCl ناچیز است؛ محلول نسبت به pH خنثی پایدارتر بوده و کندتر تجزیه میشود. |
| ۱۰٫۵ (قلیایی) | OCl⁻ تقریباً ۱۰۰٪ | پایین | بسیار زیاد | HOCl عملاً وجود ندارد؛ حداقل pH ایدهآل برای نگهداری بلند مدت سفیدکننده جهت حفظ قدرت آن. |
| ۱۲ (بسیار قلیایی) | OCl⁻ (با NaOH اضافی) | پایین (نسبی) | بسیار زیاد | pH سفیدکننده خانگی معمولی؛ پایداری بسیار بالا، اما در صورت استفاده نادرست برای بافتها و مواد شدیداً خورنده است. |
| ۱۳ (فوقالعاده قلیایی) | فقط OCl⁻ | بسیار کم | حداکثر | محلولهای غلیظ صنعتی؛ حداکثر پایداری، اما فوقالعاده خورنده بوده و نیاز به کاربری بسیار محتاطانه دارد. |




