فهرست عناوین
- مقدمه
- پیشینه تاریخی تولید سدیم هیپوکلریت
- سدیم هیپوکلریت (سفیدکننده) چیست؟
- اهمیت صنعتی و کاربردهای سدیم هیپوکلریت
- مواد اولیه اصلی و منابع آن ها برای تولید سفیدکننده
- فرآیند کلرآلکالی برای تولید کلر و سود سوزآور
- واکنش شیمیایی تولید سدیم هیپوکلریت
- واکنش های فرعی و محصولات جانبی در تولید سفیدکننده
- شرایط بهینه برای تشکیل سدیم هیپوکلریت
- فرآیند تولید هیپوکلریت سدیم در مقیاس صنعتی
- روش های الکترولیزی تولید سفیدکننده در محل
- نقش خنک سازی و پایدارسازی پس از واکنش
- کنترل کیفیت و غلظت محصول
- نگهداری و عمر مفید محلول های سدیم هیپوکلریت
نوشته شده توسط شرکت صنایع ژاول ایران
منتشر شده توسط شرکت صنایع ژاول ایران
تاریخ انتشار مقاله : 01-10-1404
تاریخ بروزرسانی مقاله : 01-10-1404
تعداد کلمات : 3400
آدرس مقاله : لینک مقاله
مواد اولیه و واکنش های تولید آب ژاول

مقدمه
سدیم هیپوکلریت که به عنوان مایع سفیدکننده شناخته می شود، ترکیبی شیمیایی است که به طور گسترده برای ضدعفونی و سفید کردن استفاده می شود. این ترکیب فرمول شیمیایی NaOCl دارد و معمولاً به صورت محلول آبی با بوی مشخص کلر وجود دارد. سفیدکننده یک ماده شیمیایی ضروری در خانه ها و صنایع هستند و به دلیل توانایی در کشتن میکروب ها و از بین بردن لکه ها ارزشمند می باشند. در صنعت، هیپوکلریت سدیم از واکنش گاز کلر با محلول سدیم هیدروکسید تولید می شود؛ فرآیندی که ساده به نظر می رسد اما در مقیاس بزرگ نیازمند کنترل دقیق شرایط است. در این مقاله بررسی می کنیم که وایتکس چگونه در مقیاس صنعتی تولید می شود و بر مواد اولیه مورد نیاز و واکنش های شیمیایی تشکیل دهنده آن تمرکز می کنیم. درک فرآیند تولید، بینشی از شیمی ارائه می دهد که سفیدکننده را به یک عامل پاک کننده قوی و رایج تبدیل کرده است.
پیشینه تاریخی تولید سدیم هیپوکلریت
تولید مدرن سفیدکننده ریشه در فرانسه اواخر قرن هجدهم دارد. در سال 1789، شیمیدان فرانسوی کلود لوئیس برتوله برای اولین بار با واکنش گاز کلر با محلول پتاس، یک محلول سفیدکننده تولید می کند که به نام «آب ژاول» شناخته شد. این شکل اولیه سفیدکننده خواص سفیدکنندگی و ضدعفونی کنندگی قوی ترکیبات کلر را نشان داد. طی دهه های بعد, شیمیدان هایی مانند آنتوان لاباراک کاربرد محلول های هیپوکلریت سدیم را برای ضدعفونی در اوایل قرن نوزدهم بیشتر توسعه دادند و به تثبیت سفیدکننده به عنوان یک عامل ضدعفونی کننده با ارزش کمک کردند. با پیشرفت شیمی صنعتی، تولید سدیم هیپوکلریت در مقیاس بزرگ امکان پذیر شد. اوایل قرن بیستم، فرآیند هوکر به عنوان روش اصلی صنعتی برای تولید سفیدکننده مطرح گردید که اساساً شامل تزریق کنترل شده گاز کلر به محلول سدیم هیدروکسید است. این فرآیند مدرن پیوسته بر پایه اکتشافات تاریخی بنا شده و امکان تولید انبوه هیپوکلریت سدیم را برای تامین نیازهای جهانی بهداشت و بهسازی فراهم می کند.
سدیم هیپوکلریت (سفیدکننده) چیست؟
سدیم هیپوکلریت یک ترکیب شیمیایی معدنی متشکل از عناصر سدیم, اکسیژن و کلر است. این ترکیب به عنوان ماده موثر در سفیدکننده کلری شناخته می شود؛ همان مایع زرد-سبز کم رنگی که معمولاً برای تمیزکاری و ضدعفونی به کار می رود. به زبان شیمی، سدیم هیپوکلریت نمک سدیم اسید هیپوکلرو است. فرمول مولکولی آن NaOCl می باشد، به این معنی که هر مولکول شامل یک یون سدیم (Na⁺) و یک یون هیپوکلریت (OCl⁻) است. هیپوکلریت سدیم در حالت خالص یک جامد ناپایدار است و لذا معمولاً به صورت حل شده در آب عرضه می شود. سفیدکننده خانگی معمولاً یک محلول ۵–۶٪ NaOCl در آب است, در حالی که محلول های سفیدکننده صنعتی می توانند ۱۰–۱۵٪ یا حتی غلیظ تر باشند. این ترکیب یک عامل اکسنده قوی است و همین خاصیت باعث می شود بتواند به طور موثر پارچه ها را سفید و باکتری ها, ویروس ها و قارچ ها را نابود کند. بوی متمایز وایتکس ناشی از آزاد شدن تدریجی کلر از محلول آن است. به طور کلی هویت شیمیایی هیپوکلریت سدیم به عنوان یک اکسیدکننده پایه کلر دلیل کاربرد وسیع آن به عنوان ماده سفیدکننده و ضدعفونی کننده است.
اهمیت صنعتی و کاربردهای سدیم هیپوکلریت
سفیدکننده ها کاربردهای گسترده ای دارند که آن را به ماده ای با اهمیت بالای صنعتی تبدیل کرده است. در تاسیسات تصفیه آب، از هیپوکلریت سدیم برای گندزدایی آب آشامیدنی و ضدعفونی فاضلاب استفاده می شود تا با حذف پاتوژن ها، آب برای مصرف یا رهاسازی ایمن شود. در بهداشت و ضدعفونی محیطی, این ماده به عنوان یک ضدعفونی کننده قوی برای سطوح در بیمارستان ها، آزمایشگاه ها و اماکن عمومی به کار می رود. صنایع نساجی و کاغذ نیز از خاصیت سفیدکنندگی هیپوکلریت سدیم بهره می برند و در فرآیندهای تولید، پارچه ها و خمیر چوب را سفید می کنند. سفیدکننده خانگی که شکل رقیق شده هیپوکلریت سدیم است، به عنوان یک ماده اصلی در خانه ها برای سفید کردن لباس ها، لکه بری و تمیزکاری عمومی به کار می رود و به همین دلیل خرید آب ژاول ارومیه برای مصرف کنندگان صنعتی و توزیع کنندگان منطقه ای اهمیت ویژه ای دارد. در کارخانجات فرآوری مواد غذایی نیز از این ماده برای ضدعفونی تجهیزات و سطوح استفاده می شود، زیرا در نابودی باکتری ها و ویروس ها موثر است. استفاده گسترده از هیپوکلریت سدیم در این حوزه ها به این معنی است که حجم زیادی از آن باید به طور پیوسته تولید شود. نقش آن در بهداشت عمومی، مانند کنترل شیوع بیماری ها از طریق ضدعفونی محیط ها، تولید هیپوکلریت سدیم را به بخشی حیاتی از عملیات صنعتی شیمیایی مدرن تبدیل کرده است.
مواد اولیه اصلی و منابع آن ها برای تولید سفیدکننده
تولید سدیم هیپوکلریت به چند ماده اولیه اساسی متکی است که عناصر شیمیایی لازم را تامین می کنند. ماده اصلی، گاز کلر است که کلر مورد نیاز برای تشکیل یون هیپوکلریت را فراهم می کند. کلر اغلب به صورت درجا از طریق الکترولیز سدیم کلرید (نمک طعام) در یک واحد کلرآلکالی تولید می شود و بدین ترتیب عرضه ای خالص و پیوسته تضمین می گردد. دومین ماده اولیه کلیدی، سدیم هیدروکسید (NaOH) یا سود سوزآور است که یون های سدیم و محیط قلیایی لازم برای واکنش را فراهم می کند. سدیم هیدروکسید معمولاً به عنوان محصول مشترک همان فرآیند الکترولیز نمک که کلر را تولید می کند به دست می آید، یا می تواند به صورت محلول غلیظ از تامین کنندگان شیمیایی تهیه شود. آب سومین جزء اساسی است که به عنوان حلال و محیط واکنش عمل می کند؛ آب همچنین خود در واکنش شیمیایی شرکت کرده و محلول هیپوکلریت سدیم حاصله را به غلظت مطلوب رقیق می سازد. آب با خلوص بالا ترجیح داده می شود تا از ورود یون های فلزی یا سایر ناخالصی هایی که ممکن است پایداری سفیدکننده را مختل کنند جلوگیری شود. در برخی فرآیندها، ماده اولیه جایگزینی مانند سدیم کربنات (خاکستر سودا) برای واکنش با کلر به کار می رود، اما این مسیر محصولی کم پایدارتر ایجاد می کند و کمتر معمول است. کلیه مواد اولیه معمولاً پیش از استفاده از نظر کیفیت و خلوص آزموده می شوند تا واکنش ها به شکل کارآمد انجام گرفته و محصول نهایی سفیدکننده کیفیت بالایی داشته باشد. در زیر مروری بر مواد و ترکیبات اصلی درگیر در تولید سدیم هیپوکلریت ارائه شده است:
| ماده | فرمول | نقش در فرایند | منبع | ویژگی های کلیدی |
|---|---|---|---|---|
| سدیم کلرید (نمک) | NaCl | ماده اولیه (برای الکترولیز) | استخراج از معادن نمک یا آب نمک دریا | جامد بلوری؛ برای تولید Cl₂ و NaOH استفاده می شود. |
| آب | H₂O | حلال و واکنش دهنده | آب تصفیه شده | مایع؛ واکنش دهنده ها را حل می کند و واکنش شیمیایی را تسهیل می کند. |
| گاز کلر | Cl₂ | واکنش دهنده (عامل کلرزنی) | تولید از الکترولیز آب نمک یا حمل در سیلندرها | گازی سمی به رنگ زرد مایل به سبز؛ کلر لازم برای تشکیل NaOCl را فراهم می کند. |
| سدیم هیدروکسید | NaOH | واکنش دهنده (ماده قلیایی) | محصول جانبی الکترولیز نمک یا سود سوزآور تجاری | جامد سفید یا محلول ۵۰٪؛ باز خورنده ای که با کلر واکنش می دهد. |
| سدیم هیپوکلریت | NaOCl | محصول اصلی (سفیدکننده) | تشکیل شده در راکتور از واکنش Cl₂ و NaOH | در برابر گرما و نور ناپایدار است؛ محلولی زرد کم رنگ با قدرت اکسیدکنندگی بالا. |
| گاز هیدروژن | H₂ | محصول جانبی (مرحله الکترولیز نمک) | در کاتد طی الکترولیز آب نمک آزاد می شود | گازی سبک و قابل اشتعال؛ معمولا جمع آوری یا به شکل ایمن تخلیه می شود. |
| سدیم کربنات | Na₂CO₃ | واکنش دهنده جایگزین (فرایند خاکستر سودا) | استخراج از ترونا یا تولید شیمیایی | پودر سفید؛ NaOCl و NaHCO₃ تولید می کند و در صنعت کمتر استفاده می شود. |
فرآیند کلرآلکالی برای تولید کلر و سود سوزآور
بسیاری از واحدهای تولید سفیدکننده با فرآیند کلرآلکالی که روش صنعتی تولید گاز کلر و سدیم هیدروکسید از نمک است، یکپارچه هستند. در یک واحد کلرآلکالی، جریان برق از میان محلول آب نمک غلیظ (کلرید سدیم در آب) در یک سلول الکترولیتی عبور داده می شود. این امر باعث جداسازی شیمیایی می گردد: در آند (الکترود مثبت)، یون های کلرید اکسید شده و گاز کلر (Cl₂) تشکیل می دهند، در حالی که در کاتد (الکترود منفی)، آب کاهش یافته و گاز هیدروژن (H₂) و یون های هیدروکسید (OH⁻) تولید می شوند. یون های هیدروکسید با یون های سدیم باقی مانده Na⁺ حاصل از نمک ترکیب شده و سدیم هیدروکسید را در محلول تشکیل می دهند. این فرآیند دو واکنش گر حیاتی مورد نیاز برای تولید سدیم هیپوکلریت را به دست می دهد. گاز کلر پس از تولید معمولاً خنک و خشک می شود و سپس یا بلافاصله در محل مصرف می شود یا برای مدت کوتاهی تحت فشار ذخیره می گردد. سدیم هیدروکسید نیز اغلب به صورت محلول آبی با غلظت حدود ۵۰٪ تولید می شود. با تولید همزمان Cl₂ و NaOH در یک واحد، فرآیند کلرآلکالی جریان پیوسته و کارآمدی از واکنش گرهای پرخلوص را برای تولید سفیدکننده فراهم می کند، بدون خطرات حمل و نقل کلر در مسافت های طولانی.
واکنش شیمیایی تولید سدیم هیپوکلریت
واکنش شیمیایی اساسی برای تولید سدیم هیپوکلریت، ترکیب گاز کلر با محلول سدیم هیدروکسید است. این واکنش کلی را می توان با معادله موازنه شده زیر نمایش داد:
Cl₂ + 2 NaOH → NaOCl + NaCl + H₂O
در این واکنش یک مولکول کلر (Cl₂) با دو مولکول سدیم هیدروکسید (NaOH) واکنش می دهد. کلر عملاً بین دو فرآورده تقسیم می شود: سدیم هیپوکلریت (NaOCl) که دارای یکی از اتم های کلر است، و سدیم کلرید (NaCl) یا همان نمک طعام که اتم دیگر کلر را در بر دارد. آب (H₂O) نیز به عنوان بخشی از واکنش تشکیل می شود. این واکنش نوعی واکنش نامتناسب سازی است که در آن گاز کلر (با عدد اکسایش ۰) به طور همزمان کاهش و اکسید می یابد به ترتیب یون کلرید Cl⁻ در NaCl و یون هیپوکلریت ClO⁻ در NaOCl را تشکیل می دهد. استوکیومتری واکنش نسبت ۲:۱ NaOH به Cl₂ را نیاز دارد. به بیان عملی، تولیدکنندگان غالباً اندکی NaOH بیشتر از این نسبت استوکیومتری استفاده می کنند تا واکنش را به تکمیل سوق داده و محلول سفیدکننده حاصل پایدارتر بماند. این واکنش به محض ورود گاز کلر به محلول کاستیک سودا به سرعت پیش می رود و گرما آزاد می کند (واکنش گرماده) زیرا طی آن سدیم هیپوکلریت و سدیم کلرید تشکیل می شوند.
واکنش های فرعی و محصولات جانبی در تولید سفیدکننده
اگر شرایط به خوبی کنترل نشوند، علاوه بر واکنش اصلی، چند واکنش جانبی نیز ممکن است در تولید سفیدکننده رخ دهد. گرمای بیش از حد یا ناکافی بودن محیط قلیایی می تواند منجر به تشکیل سدیم کلرات (NaClO₃) به عنوان ناخالصی به جای هیپوکلریت شود. همچنین ممکن است هیپوکلریت تجزیه شده و کلرید سدیم و گاز اکسیژن (O₂) ایجاد کند؛ این تجزیه در دماهای بالاتر، در معرض نور خورشید، یا حضور ناخالصی های فلزی (مانند مس یا نیکل) تسریع می شود. این فرآیند علاوه بر کاهش محتوای کلر فعال (قدرت سفیدکنندگی) سفیدکننده، می تواند باعث افزایش فشار در ظروف سربسته به دلیل آزاد شدن اکسیژن شود. محصول جانبی اصلی مورد نظر از واکنش اصلی سدیم کلرید (NaCl) است که به همراه هیپوکلریت سدیم در محلول باقی می ماند. در فرآیندهایی که از سدیم کربنات (خاکستر سودا) به عنوان منبع قلیا استفاده می شود، محصول جانبی دیگر سدیم بی کربنات (NaHCO₃) است که در کنار NaOCl تشکیل می شود. تولیدکنندگان با خنک نگه داشتن مخلوط واکنش، حفظ اضافی NaOH (pH بالا) و اجتناب از ورود فلزات کاتالیزگر، واکنش های جانبی را به حداقل می رسانند تا بیشترین بخش کلر به سدیم هیپوکلریت مطلوب تبدیل شود.
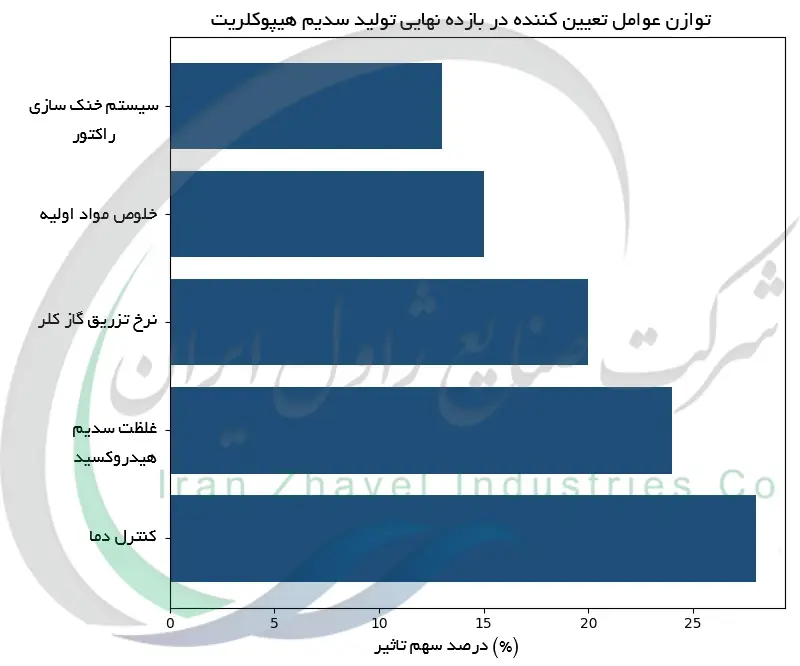
شرایط بهینه برای تشکیل سدیم هیپوکلریت
کنترل شرایط واکنش برای تولید کارآمد و ایمن سدیم هیپوکلریت ضروری است. دما یکی از عوامل مهم است؛ مخلوط کلر و NaOH در حین تولید خنک نگه داشته می شود حدود ۲۰–۳۰ °C و از مبدل های حرارتی یا پوسته های خنک کننده استفاده می شود زیرا واکنش گرماده است و گرمای بیش از حد می تواند تشکیل کلرات را تسریع یا محصول را تخریب کند. حفظ قلیاییت بالا نیز حیاتی است (pH بالای ۱۱). تولیدکنندگان مقدار اندکی سدیم هیدروکسید اضافی (قلیای آزاد باقیمانده) در محلول نگه می دارند تا سفیدکننده پایدار مانده و از تجزیه آن جلوگیری شود. غلظت واکنش گرها نیز با دقت تنظیم می شود؛ استفاده از محلول سدیم هیدروکسید با غلظت متوسط مثلاً NaOH با غلظت ۲۰–۵۰٪ به دست یابی به غلظت مطلوب سفیدکننده حدود ۱۲٪ NaOCl کمک می کند بدون اینکه محلول نهایی بیش از حد شور و غلیظ شود. گاز کلر با نرخ کنترل شده و اغلب توسط افشانک های ریز وارد محلول قلیا می گردد تا اطمینان حاصل شود به طور کامل با محلول واکنش می دهد. واکنش در تجهیزات مات یا پوشیده انجام می شود تا از نور خورشید محافظت شود زیرا نور UV می تواند هیپوکلریت را تجزیه کند. با بهینه سازی دما، pH، غلظت و اختلاط، تولیدکنندگان بازده تشکیل سدیم هیپوکلریت را حداکثر کرده و محصولات جانبی و تجزیه ناخواسته را به حداقل می رسانند.
فرآیند تولید هیپوکلریت سدیم در مقیاس صنعتی
در مقیاس صنعتی، هیپوکلریت سدیم با ترکیب محتاطانه گاز کلر و سود سوزآور در یک سیستم راکتوری کنترل شده تولید می شود. این فرآیند نمونه ای شاخص از روش ها و فناوری های تولید صنعتی آب ژاول است که در آن کنترل دقیق شرایط عملیاتی نقش تعیین کننده ای دارد. در یک فرآیند معمول، گاز کلر به صورت اندازه گیری شده به قسمت پایینی یک مخزن واکنش حاوی محلول رقیق و خنک شده سدیم هیدروکسید(مثلاً NaOH با غلظت حدود ۱۵–۲۰ ٪ تزریق می گردد. با بالا آمدن حباب های کلر در مایع، آن گاز حل شده و واکنش می دهد تا سدیم هیپوکلریت تشکیل شود. واکنش گرما تولید می کنند، بنابراین کویل های خنک کننده یا مبدل های حرارتی گرمای اضافی را دفع می کنند تا دما در محدوده مطلوب باقی بماند. سرعت تزریق کلر طوری تنظیم می شود که توسط NaOH موجود کاملاً مصرف شود؛ کلر واکنش نداده احتمالی توسط یک مرحله جذب کاستیک ثانویه (اسکرابر قلیا) مهار می شود تا از انتشار آن جلوگیری گردد. محتویات راکتور در تمام مدت به شدت قلیایی نگه داشته می شوند تا اطمینان حاصل شود گاز کلر کاملاً به هیپوکلریت و کلرید تبدیل می شود. در برخی سیستم های بزرگ، از چندین مرحله واکنش یا برج های بسته بندی شده استفاده می شود تا تماس بین گاز و مایع برای بهره وری حداکثری شود. هنگامی که غلظت هدف NaOCl (معمولاً حدود ۱۰–۱۵٪ وزنی) حاصل شد، محلول سفیدکننده به مخازن ذخیره منتقل می شود. تولید سفیدکننده اغلب به صورت بچ های روزانه یا جریان پیوسته بنا به نیاز انجام می شود تا عرضه تازه ای فراهم گردد، زیرا هیپوکلریت سدیم به مرور زمان به تدریج از شدت اثر خود می کاهد.
روش های الکترولیزی تولید سفیدکننده در محل
علاوه بر روش سنتی واکنش کلر و قلیا، می توان سدیم هیپوکلریت را از طریق الکترولیز مستقیم محلول های نمکی در تجهیزات ویژه نیز تولید کرد. این روش تولید در محل غالباً در مواردی مانند استخرهای شنا، تاسیسات کوچک تصفیه آب یا مکان های دورافتاده به کار می رود که حمل یا ذخیره مقادیر زیاد کلر عملی یا ایمن نیست. در یک مولد سفیدکننده الکترولیزی، محلول آب نمک از یک سلول الکتروشیمیایی عبور داده می شود که کلر و سدیم هیدروکسید را در همان محل تولید می کند. برخلاف یک کارخانه کلرآلکالی بزرگ، در این واحدها کلر تولیدشده به سرعت حل شده و با سدیم هیدروکسید موجود در همان محلول واکنش می دهد و یک محلول هیپوکلریت سدیم با غلظت پایین معمولاً حدود ۰٫۸ ٪ تا ۱ ٪ NaOCl به دست می آید. کلیت شیمیایی این روش مشابه فرآیند کلرآلکالی است، با این تفاوت که کلر به صورت گاز جداگانه جمع آوری نمی شود – بلکه بلافاصله مصرف و به سفیدکننده تبدیل می شود. گاز هیدروژن همچنان به عنوان محصول جانبی تولید می شود و باید به صورت ایمن تخلیه گردد. سیستم های تولید در محل به دلیل ایمنی و سهولت مورد توجه اند: آن ها نیاز به کار با گاز کلر پرفشار یا سفیدکننده غلیظ را از بین می برند و فقط به میزان نیاز و در زمان مورد نیاز تولید می کنند. البته این سیستم ها معمولاً سفیدکننده رقیق تری تولید می کنند که برای استفاده فوری در گندزدایی (مانند کلرزنی آب استخر یا تصفیه آب آشامیدنی) مناسب است اما برای بسته بندی یا نگهداری درازمدت طراحی نشده است.
نقش خنک سازی و پایدارسازی پس از واکنش
پس از تشکیل هیپوکلریت سدیم در راکتور، مراحل حیاتی بعدی خنک کردن و پایدارسازی محلول است. بلافاصله پس از واکنش، ادامه یا تشدید خنک سازی برای کاهش سریع دمای محلول سفیدکننده ضروری است تا از تجزیه آن جلوگیری شود. در تولید صنعتی، سفیدکننده تازه تولید شده معمولاً از مبدل های حرارتی عبور داده می شود یا به یک مخزن خنک کننده منتقل می گردد. در برخی موارد، در این مرحله محلول را با افزودن آب رقیق می کنند تا هم به غلظت دقیق موردنظر برسد و هم به خنک شدن بیشتر آن کمک کند. برای پایدارسازی محصول، اندکی سود سوزآور اضافی در محلول نهایی باقی می گذارند تا pH محلول شدیداً قلیایی بماند؛ محیط قلیایی قوی سرعت تجزیه هیپوکلریت را به طور قابل ملاحظه ای کاهش می دهد. همچنین ناخالصی ها به ویژه یون های فلزی که تجزیه را کاتالیز می کنند به حداقل رسانده یا خنثی می شوند. به عنوان مثال برخی تولیدکنندگان مقادیر کمی سیلیکات سدیم یا افزودنی های مشابه اضافه می کنند تا فلزات جزئی را به دام انداخته و مانع تسریع تجزیه توسط آن ها شوند. سفیدکننده خنک شده و پایدارشده در مخازن مقاوم در برابر خوردگی و محافظت شده در برابر UV (معمولاً از جنس پلاستیک یا فولاد پوشش دار) ذخیره می شود تا از نور محافظت شده و از واکنش با فلزات جلوگیری گردد. با خنک سازی سریع و حفظ شرایط شیمیایی مناسب، تولیدکنندگان اطمینان می یابند که هیپوکلریت سدیم از لحظه تولید تا زمان رسیدن به دست مصرف کننده، قدرت خود را حفظ می کند.
کنترل کیفیت و غلظت محصول
کنترل کیفیت بخش مهمی از تولید سدیم هیپوکلریت است تا اطمینان حاصل شود هر بچ مطابق استانداردهای لازم از نظر قدرت و خلوص می باشد. غلظت سفیدکننده که اغلب به صورت درصد کلر آزاد یا درصد NaOCl بیان می شود آزمایش می گردد و معمولاً با روش تیتراسیون شیمیایی اندازه گیری می شود تا مشخص شود با مقدار مورد نظر مطابقت دارد (مثلاً حدود ۵٪ برای سفیدکننده خانگی یا ۱۲٪ برای درجه صنعتی). اگر یک بچ قوی تر از حد نیاز باشد، با افزودن آب به غلظت هدف رقیق می شود؛ و اگر کمی ضعیف باشد، با افزودن مقداری کلر بیشتر تحت شرایط کنترل شده یا مخلوط کردن با بچ قوی تر تنظیم می شود. میزان قلیای آزاد محلول (سود واکنش نداده) نیز اندازه گیری می شود زیرا وجود حداقلی از NaOH باقی مانده برای پایداری سفیدکننده ضروری است. سطح ناخالصی ها نیز بررسی می شود: به عنوان مثال، مقدار سدیم کلرات، کلریدها و فلزات سنگین مانند آهن یا مس پایش می گردد تا اطمینان حاصل شود زیر حدود مجاز هستند. ظاهر محصول نیز بررسی می شود تا تایید شود محلول شفاف به رنگ زرد-سبز کم رنگ و بدون ذرات معلق است. تمامی مخازن ذخیره و ظروف حمل با ذکر غلظت محصول و تاریخ تولید برچسب گذاری می شوند، زیرا قدرت اثر سفیدکننده به مرور زمان کاهش می یابد. از طریق آزمون های دقیق و تنظیمات لازم، تولیدکنندگان یک محصول سفیدکننده یکنواخت و قابل اطمینان را به دست مصرف کنندگان و صنایع می رسانند.
نگهداری و عمر مفید محلول های سدیم هیپوکلریت
محلول های سدیم هیپوکلریت در درازمدت تا حدودی ناپایدار هستند و بنابراین شرایط نگهداری مناسب برای حداکثر کردن عمر مفید آن ها مهم است. معمولاً سفیدکننده ها به مرور زمان تجزیه شده و با تشکیل کلرید (نمک) و کلرات از قدرتشان کاسته می شود، خصوصاً اگر در معرض گرما یا نور خورشید باشند. برای کاهش این امر، سفیدکننده را در شرایط خنک و تاریک نگهداری می کنند. مخازن یا ظروف ذخیره معمولاً از موادی مانند پلی اتیلن، فایبرگلاس یا فولاد پوشش دار ساخته می شوند که در برابر خاصیت خورندگی سفیدکننده مقاوم بوده و تجزیه آن را کاتالیز نمی کنند. مخازن دارای دریچه تهویه هستند تا گاز اکسیژن (ناشی از تجزیه آهسته) به طور ایمن خارج شود و از افزایش فشار جلوگیری گردد. سفیدکننده های غلیظ تر (مثلاً با ۱۲–۱۵٪ کلر فعال) سریع تر از سفیدکننده خانگی رقیق تجزیه می شوند، بنابراین اغلب نسبتاً سریع پس از تولید مصرف می شوند. به طور کلی، تولیدکنندگان معمولاً سفیدکننده را نزدیک به زمان و محل مصرف تولید و توزیع می کنند تا تازگی آن حفظ شود. به مصرف کنندگان نیز توصیه می شود سفیدکننده را در جای خنک و دور از نور مستقیم نگهداری کرده و طی چند ماه پس از خرید مصرف کنند تا حداکثر اثربخشی را داشته باشد. همچنین بسیار مهم است که سفیدکننده را دور از اسیدها یا محصولات حاوی آمونیاک نگهداری کنید، زیرا در صورت مخلوط شدن سفیدکننده با چنین موادی، گازهای خطرناک آزاد می شود.




